รศ.นพ.ศักรินทร์ จิรพงศธร
แผนกโรคทางเดินอาหารและตับ กองอายุรกรรม โรงพยาบาลพระมงกุฎเกล้า
ภาควิชาอายุรศาสตร์ วิทยาลัยแพทยศาสตร์พระมงกุฎเกล้า
Spontaneous bacterial peritonitis (SBP) คือ การติดเชื้อแบคทีเรียของสารน้ำในช่องท้องที่เกิดขึ้นเอง โดยเป็นภาวะที่พบได้ในผู้ป่วยตับแข็งที่มีภาวะท้องมาน (ascites) ซึ่งสัมพันธ์กับการเพิ่มความเสี่ยงในการเสียชีวิต ผู้ป่วยตับแข็งที่มีภาวะท้องมานและสงสัยภาวะติดเชื้อของสารน้ำในช่องท้องอาจมีอาการแสดง เช่น ไข้ ปวดท้อง ซึมสับสน ซึ่งแพทย์ควรรีบให้การวินิจฉัยและให้การรักษาอย่างเร่งด่วน เนื่องจากหากวินิจฉัยและให้การรักษาช้าอาจส่งผลให้เกิดการติดเชื้อในกระแสเลือดและเพิ่มความเสี่ยงในการเสียชีวิต
คำนิยาม
Spontaneous bacterial peritonitis (SBP) เป็นการติดเชื้อของสารน้ำในช่องท้องโดยเป็นการติดเชื้อแบบปฐมภูมิ (primary spontaneous peritonitis) ซึ่งเป็นการติดเชื้อแบคทีเรียโดยไม่มีสาเหตุตั้งต้นมาจากอวัยวะในช่องท้อง ซึ่งต่างจากการติดเชื้อทุติยภูมิ (secondary peritonitis) ซึ่งหมายถึง การติดเชื้อสารน้ำโดยมีเหตุเริ่มต้นจากโรคในช่องท้อง เกิดการอักเสบติดเชื้อ หรืออาจเกิดผลข้างเคียงการติดเชื้อจนมีการแตกทะลุของลำไส้ เช่น ไส้ติ่งอักเสบ แผลเปปติกทะลุ หรือ colonic diverticulitis เป็นต้น โดยทั่วไปได้มีการกำหนดเกณฑ์การวินิจฉัย SBP โดยการเจาะท้องเพื่อดูดสารน้ำโดยในภาวะ SBP จะตรวจพบเม็ดเลือดขาวนิวโตรฟิลในสารน้ำจากช่องท้องตั้งแต่ 250 เซลล์/มม3 ขึ้นไปร่วมกับการเพาะเชื้อพบแบคทีเรียในสารน้ำ โดยไม่มีเหตุให้สงสัยการติดเชื้อทุติยภูมิ1
ระบาดวิทยา
SBP เป็นโรคที่พบได้บ่อยในผู้ป่วยตับแข็งที่มีภาวะท้องมาน ข้อมูลจากสำนักงานหลักประกันสุขภาพแห่งชาติพบว่า ในระหว่างปี พ.ศ. 2552 ถึง 2556 พบผู้ป่วยที่มีภาวะท้องมานประมาณร้อยละ 8.6 จากจำนวนผู้ป่วยโรคตับแข็งที่รับการรักษาในโรงพยาบาลในระบบประกันสุขภาพแห่งชาติ โดยพบว่าผู้ป่วยที่เกิด SBP มีความเสี่ยงในการเกิด hospital readmission ภายใน 30 วันหลังจำหน่ายผู้ป่วย2 มีการศึกษาติดตามผู้ป่วยโรคตับแข็งที่ได้รับการรักษาในโรงพยาบาลด้วยภาวะท้องมานพบว่ามีความชุกของการเกิด SBP ร้อยละ 10 ถึง 303 โดยมีอัตราการเสียชีวิตในโรงพยาบาลเฉลี่ยร้อยละ 10 ถึง 46 ในแต่ละสถานการณ์4 นอกจากนี้ยังพบว่าโดยเฉลี่ยครึ่งหนึ่งของโรค SBP เกิดในขณะผู้ป่วยโรคตับแข็งเข้ารับการรักษาในโรงพยาบาล5 ความชุกของ SBP ในคลินิกผู้ป่วยนอกพบได้ประมาณร้อยละ 1.5 ถึง 3.5 สาเหตุที่ผู้ป่วยส่วนใหญ่มักได้รับการวินิจฉัย SBP ในโรงพยาบาลเนื่องจากอาการของโรคที่มีไข้ ปวดท้อง ท้องเสีย หรือติดเชื้อในกระแสเลือด ซึ่งอาจส่งผลให้ผู้ป่วยมักจะถูกรับไว้ในโรงพยาบาลด้วยอาการดังกล่าว นอกจากนี้ผู้ป่วย SBP จำนวนหนึ่งอาจไม่มีอาการ หรือมีอาการน้อยมากที่ไม่จำเพาะเจาะจง เช่น อ่อนเพลีย ซึมลง หรือตรวจพบปริมาณเม็ดเลือดขาวในเลือดสูงขึ้น หรือมีการทำงานของไตที่ลดลง
กลไกการเกิด SBP ส่วนใหญ่เกิดจากการเกิด bacterial translocation จากลำไส้ แต่ก็มีรายงานการแพร่กระจายของเชื้อแบคทีเรียจากบริเวณอื่นๆ ได้ เช่น จากการติดเชื้อในทางเดินปัสสาวะ6,7 โดยแบคทีเรียส่วนใหญ่ที่เป็นสาเหตุของ SBP มักเป็นแบคทีเรียกรัมลบ กลุ่ม gram-negative enteric organism ได้แก่ Escherichia coli และ Klebsiella pneumoniae ในปัจจุบันพบการเปลี่ยนแปลงเชื้อแบคทีเรียที่เป็นสาเหตุของการเกิด SBP ไปจากเดิม กล่าวคือเริ่มมีรายงานการเกิด SBP จากเชื้อแบคทีเรียกรัมบวกกลุ่ม gram-positive cocci เช่น Streptococcus pneumoniae Staphylococcus sp. และ Enterococcus sp. มากขึ้น8
การวินิจฉัย
การวินิจฉัยโดยอาศัยข้อมูลทางคลินิก
ภาวะ SBP ส่วนใหญ่มักคิดถึงในกรณีที่ผู้ป่วยโรคตับแข็งตรวจพบท้องมาน โดยที่มีลักษณะทางคลินิกที่สงสัยหรือสัมพันธ์กับการติดเชื้อ ได้แก่ ปวดท้อง มีไข้ ถ่ายอุจจาระเหลว หรือตรวจพบปริมาณเม็ดเลือดขาวสูงขึ้นในเลือด ซึ่งแพทย์จะต้องทำการระลึกอยู่เสมอว่าลักษณะทางคลินิกของผู้ป่วยที่วินิฉัยภาวะ SBP จะต้องไม่มีลักษณะที่สงสัยการติดเชื้อทุติยภูมิ (secondary peritonitis) ซึ่งหมายถึง การติดเชื้อสารน้ำโดยมีเหตุเริ่มต้นจากโรคในช่องท้อง เกิดการอักเสบติดเชื้อ หรืออาจเกิดผลข้างเคียงการติดเชื้อจนมีการแตกทะลุของลำไส้ นอกจากนี้การวินิจฉัยภาวะ SBP จะต้องมีการวินิจฉัยด้วยการส่งตรวจสารน้ำในช่องท้อง พบปริมาณเซลล์เม็ดเลือดขาวนิวโทรฟิลมากกว่า 250 เซลล์ต่อมม.3 ซึ่งถือเป็นการวินิจฉัยในเบื้องต้น (preliminary diagnosis) เมื่อผลการการเพาะเชื้อตรวจพบแบคทีเรียในสารน้ำในช่องท้อง ก็จะเป็นการยินยันการวินิจฉัยภาวะ SBP โดยในเวชปฏิบัติอาจพบผู้ป่วยที่มาด้วยอาการที่สงสัย SBP แบบไม่ตรงตามคำนิยาม เนื่องจากบางครั้งอาจมีปัจจัยอื่นๆ ที่ส่งผลกระทบต่อการวินิจฉัยและรักษา โดยมีการแบ่งกลุ่มย่อยของ SBP ตามผลตรวจน้ำในช่องท้อง ผลการเพาะเชื้อ และลักษณะทางคลินิกตามรายละเอียดในข้างต้น นอกจากนี้อาจพบภาวะ SBP ในผู้ป่วยโรคตับแข็งที่มีภาวะท้องมานโดยไม่มีอาการ เพราะฉะนั้นแพทย์ควรพึงระลึกถึงภาวะนี้เสมอและรีบดำเนินการเจาะท้องเพื่อนำสารน้ำในช่องท้องมาตรวจเพื่อค้นหาภาวะนี้แม้ผู้ป่วยอาจไม่มีอาการในระบบทางเดินอาหาร เช่น ในกรณีที่พบผู้ป่วยโรคตับแข็งที่มีภาวะท้องมานเป็นครั้งแรก หรือเป็นผู้ป่วยโรคตับแข็งที่มีภาวะท้องมานซึ่งได้รับการรักษาในโรงพยาบาล หรือพบผู้ป่วยโรคตับแข็งที่มีการทำงานของอวัยวะต่างๆ ที่แย่ลง เช่น เกิดภาวะแทรกซ้อนต่างๆ ได้แก่ โรคสมองเหตุจากโรคตับ (hepatorenal syndrome) เลือดออกในทางเดินอาหาร มีการทำงานของไตที่แย่ลง หรือเกิด hepatorenal syndrome เป็นต้น
การตรวจทางห้องปฏิบัติการ
ในปัจจุบันการส่งสารน้ำในช่องท้องเพื่อตรวจนับจำนวนเม็ดเลือดขาวนิวโตรฟิล โดยอาจใช้วิธีการตรวจด้วย counting chamber โดยการนับมือ หรือการตรวจนับด้วยเครื่อง automated cell count หรือวิธี flow cytometry ถือเป็น gold standard ในการวินิจฉัย มีการศึกษาโดยใช้แถบตรวจปัสสาวะสำเร็จรูป (urinary reagent strip) มาเทียบเคียงว่ามีการติดเชื้อ SBP ในสารน้ำจากช่องท้องหรือไม่ พบว่าแม้การตรวจโดยใช้แถบตรวจปัสสาวะสำเร็จรูปจะมีความรวดเร็วในการช่อยคัดกรองโรค SBP แต่ยังมีความไวและความแม่นยำที่ต่ำ9 ในต่างประเทศมีการตรวจหาสาร lactoferrin ในสารน้ำในช่องท้อง (ascitic fluid lactoferrin, AFLAC) ซึ่ง lacteferrin สร้างมาจากเม็ดเลือดขาวนิวโตรฟิลโดยมีการพัฒนาการตรวจแบบ rapid test ซึ่งให้ผลเร็วและสามารถทำได้ข้างเตียงผู้ป่วยโดยไม่ต้องส่งตรวจในห้องปฎิบัติการ ซึ่งข้อมูลจากการศึกษาในต่างประเทศพบว่าการตรวจด้วยวิธีนี้มีความไวและความแม่นยำสูง10 แต่การตรวจด้วยวิธีนี้ยังขาดข้อมูลถึงระยะเวลาที่เหมาะสมในการส่งตรวจ ตลอดจนยังไม่มีการศึกษาขนาดใหญ่ยืนยันถึงตัวเลขที่เหมาะสมที่จะใช้ในการวินิจฉัยภาวะ SBP
การเจาะสารน้ำจากช่องท้องส่งตรวจ (Abdominal paracentesis)
ผู้ป่วยโรคตับแข็งที่มีภาวะท้องมาน สามารถทำการเจาะสารน้ำในช่องท้องส่งตรวจ เพื่อใช้ในการวินิจฉัยสาเหตุของท้องมานว่าเกิดจากภาวะแรงดันพอร์ทัลที่สูง หรือเกิดจากโรคของเยื่อบุช่องท้อง นอกจากนี้ยังเป็นวิธีมาตราฐานในการสืบค้นและวินิจฉัยภาวะ SBP โดยตำแหน่งที่สามารถทำการเจาะสารน้ำส่งตรวจทำได้หลายตำแหน่ง ตามความเห็นของผู้นิพนธ์แนะนำให้ทำการเจาะที่บริเวณช่องท้องส่วนล่างด้านซ้ายเนื่องจากบริเวณด้านซ้ายอาจมีโอกาสที่เข็มจะทิ่มแทงอวัยวสำคัญได้ยากกว่าด้านขวาที่มีลำไส้ใหญ่ส่วนต้น ซึ่งมีการยึดติดกับเยื่อบุช่องท้องส่วนหลัง โดยตำแหน่งที่ทำการเจาะควรเลือกตำแหน่งที่เป็น avascular infraumbilical midline เพื่อหลีกเลี่ยง inferior epigastric vessel โดยตำแหน่งที่เหมาะสมควรตรวจได้ shifting dullness เพื่อเป็นการยืนยันระดับของสารน้ำที่สามารถเจาะได้ นอกจากนี้แพทย์ควรใช้ Z เทคนิคทั้งในขณะฉีดขาชาและเจาะสารน้ำ ซึ่งเป็นการดึงผิวหนังของผู้ป่วยลงมาเล็กน้อยในขณะที่แทงเข็ม หลังจากนั้นให้ทำการปล่อยผิวหนังของผู้ป่วยไปในระนาบเดิม ก่อนที่จะแทงเข็มผ่านทะลุเยื่อบุช่องท้อง การทำ Z เทคนิคมีวัตถุประสงค์เพื่อให้ระนาบของเข็มที่ผิวหนังและในเยื่อบุช่องท้องไม่เป็นระนาบเดียวกัน เพื่อป้องกันการเกิดการรั่วของสารน้ำในช่องท้องออกมาที่ผิวหนังหลังทำการเจาะสารน้ำ ซึ่งอาจเกิดภาวะแทรกซ้อนที่นำมาซึ่งการติดเชื้อ หรือทำให้ผู้ป่วยไม่สุขสบายหลังเจาะสารน้ำได้ การเจาะสารน้ำจากช่องท้องส่งตรวจ โดยทั่วไปหากทำการเจาะอย่างถูกวิธีในผู้ป่วยโรคท้องมานระดับ 2 ขึ้นไป กล่าวคือตรวจร่างกายพบมีสารน้ำปริมาณมากพอจนตรวจได้ shifting dullness ถือเป็นหัตถการที่ปลอดภัย มีภาวะแทรกซ้อนต่ำ (น้อยกว่าร้อยละ 1)11 ถึงแม้ผู้ป่วยส่วนใหญ่จะมีความผิดปกติของค่าการแข็งตัวของเลือด อย่างไรก็ตามความเสี่ยงในการเกิดภาวะแทรกซ้อนที่รุนแรง เช่น การเจาะโดนลำไส้จนทะลุ หรือ hemoperitoneum ก็มีโอกาสเกิดได้ แพทย์จึงควรทำหัตถการด้วยความระมัดระวัง สำหรับในกรณีที่ผู้ป่วยมีค่าการแข็งตัวของเลือดผิดปกติ อาจไม่มีความจำเป็นที่จะต้องให้ส่วนประกอบของเลือด เช่น พลาสมา เกร็ดเลือด แก่ผู้ป่วยเพื่อทำการป้องกันเลือดออกทุกราย เนื่องจากยังขาดหลักฐานเชิงประจักษ์ในเรื่องของประโยชน์และความคุ้มค่า เนื่องจากการศึกษาส่วนใหญ่พบว่า ภาวะเลือดออก หรือ hemoperitoneum ที่เกิดขึ้นหลังการเจาะสารน้ำในช่องท้องส่งตรวจเกิดขึ้นได้น้อยมาก แม้ผู้ป่วยจะมีเกร็ดเลือดต่ำ หรือมีค่าการแข็งตัวของเลือดที่ผิดปกติจากโรคตับแข็ง12 ผู้นิพนธ์แนะนำให้ยึดแนวทางในการให้ส่วนประกอบของเลือดก่อนการทำหัตถการตามคำแนะนำของสมาคมโรคตับสหรัฐอเมริกา (American Association for the Study of Liver Diseases, AASLD) โดยแนะนำให้ส่วนประกอบของเลือดก่อนการทำหัตถการเฉพาะในกรณีที่ผู้ป่วยมีภาวะ hyperfibrinolysis หรือ disseminated intravascular coagulation (DIC)1 โดยข้อบ่งชี้ของการเจาะสารน้ำจากช่องท้องส่งตรวจ ได้สรุปไว้ในรูปที่ 1
การรักษา
หลักการในการรักษา SBP แบ่งออกได้เป็น
- การให้ยาปฏิชีวนะ
เมื่อพบผู้ป่วยที่สงสัยภาวะ SBP เช่น ผู้ป่วยโรคตับแข็งที่มีภาะวท้องมาน ร่วมกับมีอาการสงสัยการติดเชื้อ ท้องโตขึ้น กดเจ็บ หรือตรวจเลือดพบเม็ดเลือดขาวสูงผิดปกติ หรือมีการทำงานของไตที่แย่ลง แพทย์ควรทำการให้ยาปฏิชีวนะทางเส้นเลือดให้เร็วที่สุด (empirical treatment) เนื่องจากหากให้การรักษาไม่ทันท่วงที จะส่งผลให้อัตราการเสียชีวิตของผู้ป่วยเพิ่มขึ้น โดยยากลุ่ม third-generation, broad-spectrum cephalosporins ถือเป็นยาที่ผู้เชี่ยวชาญแนะนำให้เลือกพิจารณาเป็นตัวแรก ในกรณีที่สงสัย CA-SBP โดยไม่จำเป็นต้องรอผลเพาะเชื้อจากสารน้ำในช่องท้อง โดยแนะนำให้พิจารณาเลือกใช้ยา cefotaxime ขนาด 2 กรัม ทุก 8 ชั่วโมง เป็นเวลา 5 วัน1 ตามความเห็นของผู้นิพนธ์และแพทย์ผู้เชี่ยวชาญหลายท่าน ไม่แนะนำให้ใช้ ceftriaxone เป็นยาตัวแรกในการรักษา SBP เนื่องจากคุณสมบัติทางเภสัชวิทยาของ ceftriaxone ที่จำเป็นต้องจับโปรทีนในการออกฤทธิ์ ซึ่งในผู้ป่วยโรคตับแข็งที่เกิด SBP อาจมีการสร้างโปรทีนโดยเฉพาะอัลบูมินที่ต่ำ ส่งผลให้การรักษาด้วยยา ceftriaxone อาจออกฤทธิ์ได้ไม่เต็มที่เมื่อเปรียบเทียบกับยา cefotaxime4 กรณีที่ผู้ป่วยแพ้ยา penicillin อาจพิจารณาให้ยากลุ่ม fluoroquinolone นอกจากนี้หากพิจารณาแล้วพบว่า ผู้ป่วย SBP มีอาการไม่รุนแรง เช่น ไม่มีลักษณะของ sepsis อาจเลือกให้การรักษาด้วยยากลุ่ม fluoroquinolone ชนิดรับประทาน โดยแนะนำยาที่มี oral bioavailability สูง เช่น ciprofloxacin หรือ levofloxacin13 สำหรับในกรณีที่สงสัย N-SBP หรือ HCA-SBP ให้พิจารณาเลือก empirical treatment ตามหลักการของโรคติดเชื้อ รูปที่ 2 แสดงถึงแนวทางในการรักษา SBP ด้วยยาปฏิชีวนะในสถาณการณ์ต่างๆ
- การรักษาด้วยแอลบูมิน
แอลบูมินเป็นโปรทีนชนิด single chain peptide ที่สังเคราะห์จากตับโดยมีค่าครึ่งชีวิตเฉลี่ย 21 วัน โดยหน้าที่สำคัญของแอลบูมินคือช่วยในการควบคุม oncotic pressure ขนส่งฮอร์โมน กรดไขมัน ยา โลหะหนัก และสารต่างๆ ตลอดจนช่วยในการกำจัดอนุมูนอิสระ14 ข้อมูลจากการศึกษาพบว่า ผู้ป่วยโรคตับแข็งส่วนใหญ่จะมีการสร้างแอลบูมินที่ลดลงและมีรูปร่างที่ผิดปกติ ซึ่งจะส่งผลต่อการเพิ่มอัตราการเจ็บป่วยและอัตราการเสียชีวิตแก่ผู้ป่วย15 นอกจากนี้การพิจารณาให้แอลบูมินร่วมกับยาปฎิชีวนะในการรักษา SBP อาจได้ประโยชน์มากขึ้น ข้อมูลจากการศึกษาแบบสุ่มพบว่าการรักษา SBP ด้วยยา cefotaxime ร่วมกับ แอลบูมินขนาด 1.5 กรัม ต่อ น้ำหนักตัว 1 กิโลกรัม ภายใน 6 ชั่วโมงหลังวินิจฉัย SBP ตามด้วยขนาด 1 กรัม ต่อ น้ำหนักตัว 1 กิโลกรัม ในวันที่ 3 สามารถลดอัตราการเสียชีวิตทั้งในระหว่างนอนโรงพยาบาล และที่ 3 เดือนหลังติดตามการรักษา นอกจากนี้ผู้ป่วยที่ได้แอลบูมินยังสามารถชะลอการเสื่อมของไต16 อย่างไรก็ตาม การศึกษานี้ไม่ได้เป็นการศึกษาแบบสุ่มที่มีการปกปิด (double blind study) และมีผู้ป่วยบางกลุ่มเท่านั้นที่มีการศึกษายืนยันว่าอาจได้ประโยชน์จากแอลบูมิน (serum creatinine > 1 มก/ดล, bilirubin >4 มก/ดล. และ BUN >30 มก/ดล)17 และแอลบูมินยังมีราคาแพง จึงควรพิจารณาให้ร่วมกับยาปฎิชีวนะเป็นรายๆ ไป
- SBP กับการพิจารณาปลูกถ่ายตับ (liver transplantation)
ผู้ป่วย SBP ไม่ถือเป็นข้อห้ามในการปลูกถ่ายตับ อย่างไรก็ตามหากผู้ป่วยเกิด SBP แพทย์ผู้ดูแลควรพิจารณาส่งผู้ป่วยไปขึ้นทะเบียนเพื่อรอรับการผ่าตัดปลูกถ่ายตับ เนื่องจากภายหลังจากการเกิด SBP ผู้ป่วยมักจะมีการดำเนินโรคที่แย่ลงและเพิ่มอัตราการเสียชีวิตแก่ผู้ป่วย
การป้องกัน
การป้องกันการเกิด SBP แบ่งได้เป็น
- การป้องกันโรคระดับปฐมภูมิ (primary prophylaxis)
ผู้ป่วยโรคตับแข็งที่มีภาวะท้องมาน สมควรพิจารณาติดตามระดับโปรทีนและแอลบูมินของสารน้ำในช่องท้อง โดยผู้ป่วยที่มี ascitic fluid protein <1 กรัม/ดล. ควรได้รับการพิจารณาให้รับประทาน norfloxacin ขนาด 400 มก. วันละครั้งเพื่อป้องกันการเกิด SBP เนื่องจากมีหลักฐานทางการแพทย์มากที่สุด โดยข้อมูลจากการวิเคราะห์อภิมาน (meta-analysis) พบว่าการให้ยาปฎิชิวนะสามารถป้องกันการเกิด SBP และผู้ป่วยมีอัตราการรอดชีวิตที่ 3 เดือน มากกว่าผู้ป่วยที่ไม่ได้ยาปฏิชีวนะ18 โดยข้อมูลที่ได้จากการศึกษาไปข้างหน้าแบบสุ่มปกปิดทั้ง 2 ฝ่าย (double-blind, placebo-controlled trial) พบว่าผู้ป่วยโรคตับแข็งที่มีภาวะท้องมานและมี ascitic fluid protein <1 กรัม/ดล. ร่วมกับข้อใดข้อหนึ่งดังต่อไปนี้ ได้แก่ advanced cirrhosis (Child score ตั้งแต่ 9 คะแนนขึ้นไป), serum creatinine ตั้งแต่ 1.2 มก./ดล., BUN ตั้งแต่ 25 มก./ดล. หรือ serum sodium น้อยกว่าหรือเท่ากับ130 มิลลิอิควิวาเลนต์/ลิตร หากได้รับยา norfloxacin ขนาด 400 มก. รับประทาน วันละครั้ง พบว่าผู้ป่วยกลุ่มที่ได้รับประทานยาสามารถมีอัตราการรอดชีวิตที่ 3 เดือน และ 1 ปี สูงกว่ากลุ่มที่ไม่ได้รับประทานยาอย่างมีนัยสำคัญทางสถิติ นอกจากนี้เมื่อติดตามผู้ป่วยที่ 1 ปี พบว่า ผู้ป่วยที่รับประทานยาสามารถลดความเสี่ยงในการเกิด hepatorenal syndrome และ SBP อย่างมีนัยสำคัญทางสถิติ19 ล่าสุดได้มีการศึกษาไปข้างหน้าแบบสุ่มปกปิดทั้ง 2 ฝ่าย (double-blind, placebo-controlled trial) ขนาดใหญ่ยืนยันประโยชน์ของการให้ยา norfloxacin ขนาด 400 มก. รับประทาน วันละครั้ง ในผู้ป่วยโรคตับแข็งที่มีภาวะท้องมานและมี ascitic fluid protein <1.5 กรัม/ดล. พบว่าสามารถลดอัตราการสียชีวิตที่ 6 เดือน เมื่อเทียบกับกลุ่มที่ได้ยาหลอก โดยเป็นที่น่าสนใจว่าในระหว่างที่มีการติดตามการรักษาไป 1 ปีหลังเริ่มยา ไม่พบว่าการให้ยา norfloxacin ขนาด 400 มก. รับประทาน วันละครั้ง สัมพันธ์กับการเกิดเชื้อแบคทีเรียดื้อยาที่เพิ่มขึ้น20 โดยยาปฏิชีวนะชนิดอื่นที่อาจพิจารณาเป็นทางเลือกในการป้องกันการเกิด SBP ได้แก่ ยา ciprofloxacin ยา trimethoprim–sulfamethoxazole และยา rifaximin นอกจากนี้ ผู้ป่วยโรคตับแข็งที่มีเลือดออกในทางเดินอาหาร แม้จะตรวจไม่พบภาวะท้องมาน ก็ควรพิจารณาให้ยาปฎิชีวนะในขนาดป้องกันการเกิด SBP และการติดเชื้ออื่นๆ
- การป้องกันโรคระดับทุติยภูมิ (secondary prophylaxis)
ผู้ป่วยโรคตับแข็งที่เคยได้รับการวินิจฉัย SBP ควรได้ยาปฏิชีวนะรับประทานเพื่อป้องกันการเกิด SBP ไปตลอดชีวิตจนกว่าจะได้รับการผ่าตัดปลูกถ่ายตับ หรือหายจากภาวะท้องมาน เนื่องจากผู้ป่วยมักจะเกิดการติดเชื้อซ้ำได้บ่อยโดยเฉลี่ยร้อยละ 43 ภายในระยะเวลา 6 เดือนหลังวินิจฉัย SBP21 โดยแนะนำให้พิจารณายา norfloxacin ขนาด 400 มก. รับประทาน วันละครั้ง เป็นตัวแรก เนื่องจากมีการศึกษาถึงประสิทธิภาพและความปลอดภัยของยา โดยข้อมูลที่ได้จากการศึกษาไปข้างหน้าแบบสุ่มปกปิดทั้ง 2 ฝ่าย (double-blind, placebo-controlled trial) พบว่า ผู้ป่วยที่ได้รับยา norfloxacin ขนาด 400 มก. รับประทาน วันละครั้ง มีอัตราการเกิด SBP ซ้ำที่ 1 ปี (ร้อยละ 20) น้อยกว่าผู้ป้วยที่ได้ยาหลอก (ร้อยละ 68) อย่างมีนัยสำคัญทางสถิติ22 โดยยา ciprofloxacin และ ยา trimethoprim–sulfamethoxazole อาจพิจารณาเป็นตัวเลือกในการรักษาได้เช่นเดียวกัน
- การให้คำแนะนำทางด้านโภชนาการ
ผู้ป่วยโรคตับแข็งที่ได้รับการวินิจฉัย SBP มีความเสี่ยงในการเกิดภาวะทุพโภชนาการ ซึ่งจะส่งผลต่ออัตราการอยู่รอดของผู้ป่วย แพทย์ควรแนะนำให้ผู้ป่วยบริโภคโปรทีนให้เพียงพอโดยเฉลี่ยวันละ 1.2 ถึง 1.5 กรัมต่อน้ำหนักตัว โดยอาจพิจารณาแบ่งอาหารเป็นมื้อย่อยๆ 4 ถึง 6 มื้อ23 โดยเพิ่มอาหารว่างก่อนนอนที่มีส่วนประกอบของคาร์โบไฮเดรตสูง (carbohydrate‐rich snack)24 เพื่อหลีกเลี่ยงอาการแน่นท้อง โดยแนะนำให้จำกัดการบริโภคเกลือเพื่อช่วยควบคุมภาวะท้องมานและลดบวม ผู้ป่วยควรหลีกเลี่ยงอาหารดิบ อาหารที่ไม่ปรุงสุกหรือผ่านความร้อนที่เพียงพอ เนื่องจากอาจเสี่ยงต่อการติดเชื้อแบคทีเรียในกระแสเลือดที่รุนแรงถึงแก่ชีวิต สำหรับ probiotics ไม่มีข้อมูลขนาดใหญ่ยืนยันว่าได้ประโยชน์ในการรักษาและป้องกันการเกิด SBP
รูปที่ 1 ข้อบ่งชี้ในการเจาะสารน้ำในช่องท้องส่งตรวจในผู้ป่วยท้องมานเพื่อการวินิจฉัย*

*ดัดแปลงจาก Runyon BA. American Association for the Study of Liver Diseases (AASLD) Practice Guidelines Committee. Management of Adult Patients with Ascites Due to Cirrhosis: Update 2012.
รูปที่ 2 แนวทางในการรักษา spontaneous bacterial peritonitis ด้วยยาปฏิชีวนะในสถานะการณ์ต่างๆ
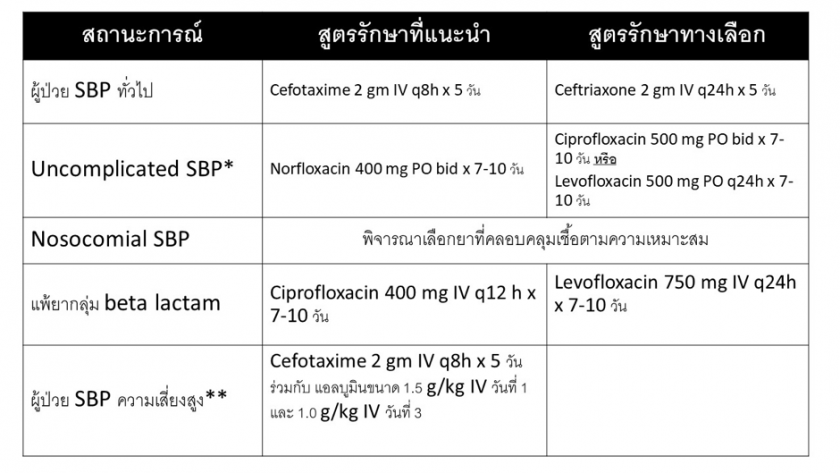
*Uncomplicated SBP หมายถึง community acquired SBP ที่ไม่มีภาวะชอค, intestinal ileus เลือดออกในทางเดินอาหาร, hepatic encephalopathy และ serum creatinine >3 มก/ดล
**ผู้ป่วย SBP ความเสี่ยงสูง หมายถึง ผู้ป่วย SBP ที่มี advanced liver หรือ renal failure ได้แก่ ตรวจพบ serum creatinine >1 มก/ดล. BUN >30 มก/ดล. หรือ total bilirubin >4 มก/ดล.
บรรณานุกรม
- Runyon BA. Introduction to the revised American Association for the Study of Liver Diseases Practice Guideline management of adult patients with ascites due to cirrhosis 2012. Hepatology 2013;57:1651-3.
- Chirapongsathorn S, Poovorawan K, Soonthornworasiri N, Pan-ngum W, Phaosawasdi K, Treeprasertsuk S. Thirty-Day Readmission and Cost Analysis in Patients With Cirrhosis: A Nationwide Population-Based Data. Hepatology Communications 2020;4:453-60.
- Hurwich DB, Lindor KD, Hay JE, Gross JB, Jr., Kaese D, Rakela J. Prevalence of peritonitis and the ascitic fluid protein concentration among chronic liver disease patients. Am J Gastroenterol 1993;88:1254-7.
- Dever JB, Sheikh MY. Review article: spontaneous bacterial peritonitis – bacteriology, diagnosis, treatment, risk factors and prevention. Alimentary Pharmacology & Therapeutics 2015;41:1116-31.
- Rimola A, García-Tsao G, Navasa M, et al. Diagnosis, treatment and prophylaxis of spontaneous bacterial peritonitis: a consensus document. Journal of Hepatology 2000;32:142-53.
- Runyon BA, Squier S, Borzio M. Translocation of gut bacteria in rats with cirrhosis to mesenteric lymph nodes partially explains the pathogenesis of spontaneous bacterial peritonitis. J Hepatol 1994;21:792-6.
- Scarpellini E, Valenza V, Gabrielli M, et al. Intestinal permeability in cirrhotic patients with and without spontaneous bacterial peritonitis: is the ring closed? Am J Gastroenterol 2010;105:323-7.
- Friedrich K, Nüssle S, Rehlen T, Stremmel W, Mischnik A, Eisenbach C. Microbiology and resistance in first episodes of spontaneous bacterial peritonitis: implications for management and prognosis. J Gastroenterol Hepatol 2016;31:1191-5.
- Nousbaum JB, Cadranel JF, Nahon P, et al. Diagnostic accuracy of the Multistix 8 SG reagent strip in diagnosis of spontaneous bacterial peritonitis. Hepatology 2007;45:1275-81.
- Parsi MA, Saadeh SN, Zein NN, et al. Ascitic fluid lactoferrin for diagnosis of spontaneous bacterial peritonitis. Gastroenterology 2008;135:803-7.
- Runyon BA. Paracentesis of ascitic fluid. A safe procedure. Arch Intern Med 1986;146:2259-61.
- Pache I, Bilodeau M. Severe haemorrhage following abdominal paracentesis for ascites in patients with liver disease. Aliment Pharmacol Ther 2005;21:525-9.
- Turnidge J. Pharmacokinetics and pharmacodynamics of fluoroquinolones. Drugs 1999;58 Suppl 2:29-36.
- Garcia-Martinez R, Caraceni P, Bernardi M, Gines P, Arroyo V, Jalan R. Albumin: pathophysiologic basis of its role in the treatment of cirrhosis and its complications. Hepatology 2013;58:1836-46.
- Jalan R, Schnurr K, Mookerjee RP, et al. Alterations in the functional capacity of albumin in patients with decompensated cirrhosis is associated with increased mortality. Hepatology 2009;50:555-64.
- Sort P, Navasa M, Arroyo V, et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. N Engl J Med 1999;341:403-9.
- Sigal SH, Stanca CM, Fernandez J, Arroyo V, Navasa M. Restricted use of albumin for spontaneous bacterial peritonitis. Gut 2007;56:597-9.
- Saab S, Hernandez JC, Chi AC, Tong MJ. Oral antibiotic prophylaxis reduces spontaneous bacterial peritonitis occurrence and improves short-term survival in cirrhosis: a meta-analysis. Am J Gastroenterol 2009;104:993-1001; quiz 2.
- Fernández J, Navasa M, Planas R, et al. Primary prophylaxis of spontaneous bacterial peritonitis delays hepatorenal syndrome and improves survival in cirrhosis. Gastroenterology 2007;133:818-24.
- Moreau R, Elkrief L, Bureau C, et al. Effects of Long-term Norfloxacin Therapy in Patients With Advanced Cirrhosis. Gastroenterology 2018;155:1816-27.e9.
- Titó L, Rimola A, Ginès P, Llach J, Arroyo V, Rodés J. Recurrence of spontaneous bacterial peritonitis in cirrhosis: frequency and predictive factors. Hepatology 1988;8:27-31.
- Ginés P, Rimola A, Planas R, et al. Norfloxacin prevents spontaneous bacterial peritonitis recurrence in cirrhosis: Results of a double-blind, placebo-controlled trial. Hepatology 1990;12:716-24.
- Nompleggi DJ, Bonkovsky HL. Nutritional supplementation in chronic liver disease: an analytical review. Hepatology 1994;19:518-33.
- O’Brien A, Williams R. Nutrition in end-stage liver disease: principles and practice. Gastroenterology 2008;134:1729-40.
Tags: Cirrhosis and PHT

