รศ.นพ.ศักรินทร์ จิรพงศธร
แผนกโรคทางเดินอาหารและตับ กองอายุรกรรม โรงพยาบาลพระมงกุฎเกล้า
ภาควิชาอายุรศาสตร์ วิทยาลัยแพทยศาสตร์พระมงกุฎเกล้า
Spontaneous bacterial peritonitis (SBP) คือ การติดเชื้อแบคทีเรียของสารน้ำในช่องท้องที่เกิดขึ้นเอง โดยเป็นภาวะที่พบได้ในผู้ป่วยตับแข็งที่มีภาวะท้องมาน (ascites) ซึ่งสัมพันธ์กับการเพิ่มความเสี่ยงในการเสียชีวิต ผู้ป่วยตับแข็งที่มีภาวะท้องมานและสงสัยภาวะติดเชื้อของสารน้ำในช่องท้องอาจมีอาการแสดง เช่น ไข้ ปวดท้อง ซึมสับสน ซึ่งแพทย์ควรรีบให้การวินิจฉัยและให้การรักษาอย่างเร่งด่วน เนื่องจากหากวินิจฉัยและให้การรักษาช้าอาจส่งผลให้เกิดการติดเชื้อในกระแสเลือดและเพิ่มความเสี่ยงในการเสียชีวิต
คำนิยาม
Spontaneous bacterial peritonitis (SBP) เป็นการติดเชื้อของสารน้ำในช่องท้องโดยเป็นการติดเชื้อแบบปฐมภูมิ (primary spontaneous peritonitis) ซึ่งเป็นการติดเชื้อแบคทีเรียโดยไม่มีสาเหตุตั้งต้นมาจากอวัยวะในช่องท้อง ซึ่งต่างจากการติดเชื้อทุติยภูมิ (secondary peritonitis) ซึ่งหมายถึง การติดเชื้อสารน้ำโดยมีเหตุเริ่มต้นจากโรคในช่องท้อง เกิดการอักเสบติดเชื้อ หรืออาจเกิดผลข้างเคียงการติดเชื้อจนมีการแตกทะลุของลำไส้ เช่น ไส้ติ่งอักเสบ แผลเปปติกทะลุ หรือ colonic diverticulitis เป็นต้น โดยทั่วไปได้มีการกำหนดเกณฑ์การวินิจฉัย SBP โดยการเจาะท้องเพื่อดูดสารน้ำโดยในภาวะ SBP จะตรวจพบเม็ดเลือดขาวนิวโตรฟิลในสารน้ำจากช่องท้องตั้งแต่ 250 เซลล์/มม3 ขึ้นไปร่วมกับการเพาะเชื้อพบแบคทีเรียในสารน้ำ โดยไม่มีเหตุให้สงสัยการติดเชื้อทุติยภูมิ1
ระบาดวิทยา
SBP เป็นโรคที่พบได้บ่อยในผู้ป่วยตับแข็งที่มีภาวะท้องมาน ข้อมูลจากสำนักงานหลักประกันสุขภาพแห่งชาติพบว่า ในระหว่างปี พ.ศ. 2552 ถึง 2556 พบผู้ป่วยที่มีภาวะท้องมานประมาณร้อยละ 8.6 จากจำนวนผู้ป่วยโรคตับแข็งที่รับการรักษาในโรงพยาบาลในระบบประกันสุขภาพแห่งชาติ โดยพบว่าผู้ป่วยที่เกิด SBP มีความเสี่ยงในการเกิด hospital readmission ภายใน 30 วันหลังจำหน่ายผู้ป่วย2 มีการศึกษาติดตามผู้ป่วยโรคตับแข็งที่ได้รับการรักษาในโรงพยาบาลด้วยภาวะท้องมานพบว่ามีความชุกของการเกิด SBP ร้อยละ 10 ถึง 303 โดยมีอัตราการเสียชีวิตในโรงพยาบาลเฉลี่ยร้อยละ 10 ถึง 46 ในแต่ละสถานการณ์4 นอกจากนี้ยังพบว่าโดยเฉลี่ยครึ่งหนึ่งของโรค SBP เกิดในขณะผู้ป่วยโรคตับแข็งเข้ารับการรักษาในโรงพยาบาล5 ความชุกของ SBP ในคลินิกผู้ป่วยนอกพบได้ประมาณร้อยละ 1.5 ถึง 3.5 สาเหตุที่ผู้ป่วยส่วนใหญ่มักได้รับการวินิจฉัย SBP ในโรงพยาบาลเนื่องจากอาการของโรคที่มีไข้ ปวดท้อง ท้องเสีย หรือติดเชื้อในกระแสเลือด ซึ่งอาจส่งผลให้ผู้ป่วยมักจะถูกรับไว้ในโรงพยาบาลด้วยอาการดังกล่าว นอกจากนี้ผู้ป่วย SBP จำนวนหนึ่งอาจไม่มีอาการ หรือมีอาการน้อยมากที่ไม่จำเพาะเจาะจง เช่น อ่อนเพลีย ซึมลง หรือตรวจพบปริมาณเม็ดเลือดขาวในเลือดสูงขึ้น หรือมีการทำงานของไตที่ลดลง
กลไกการเกิด SBP ส่วนใหญ่เกิดจากการเกิด bacterial translocation จากลำไส้ แต่ก็มีรายงานการแพร่กระจายของเชื้อแบคทีเรียจากบริเวณอื่นๆ ได้ เช่น จากการติดเชื้อในทางเดินปัสสาวะ6,7 โดยแบคทีเรียส่วนใหญ่ที่เป็นสาเหตุของ SBP มักเป็นแบคทีเรียกรัมลบ กลุ่ม gram-negative enteric organism ได้แก่ Escherichia coli และ Klebsiella pneumoniae ในปัจจุบันพบการเปลี่ยนแปลงเชื้อแบคทีเรียที่เป็นสาเหตุของการเกิด SBP ไปจากเดิม กล่าวคือเริ่มมีรายงานการเกิด SBP จากเชื้อแบคทีเรียกรัมบวกกลุ่ม gram-positive cocci เช่น Streptococcus pneumoniae Staphylococcus sp. และ Enterococcus sp. มากขึ้น8
การวินิจฉัย
การวินิจฉัยโดยอาศัยข้อมูลทางคลินิก
ภาวะ SBP ส่วนใหญ่มักคิดถึงในกรณีที่ผู้ป่วยโรคตับแข็งตรวจพบท้องมาน โดยที่มีลักษณะทางคลินิกที่สงสัยหรือสัมพันธ์กับการติดเชื้อ ได้แก่ ปวดท้อง มีไข้ ถ่ายอุจจาระเหลว หรือตรวจพบปริมาณเม็ดเลือดขาวสูงขึ้นในเลือด ซึ่งแพทย์จะต้องทำการระลึกอยู่เสมอว่าลักษณะทางคลินิกของผู้ป่วยที่วินิฉัยภาวะ SBP จะต้องไม่มีลักษณะที่สงสัยการติดเชื้อทุติยภูมิ (secondary peritonitis) ซึ่งหมายถึง การติดเชื้อสารน้ำโดยมีเหตุเริ่มต้นจากโรคในช่องท้อง เกิดการอักเสบติดเชื้อ หรืออาจเกิดผลข้างเคียงการติดเชื้อจนมีการแตกทะลุของลำไส้ นอกจากนี้การวินิจฉัยภาวะ SBP จะต้องมีการวินิจฉัยด้วยการส่งตรวจสารน้ำในช่องท้อง พบปริมาณเซลล์เม็ดเลือดขาวนิวโทรฟิลมากกว่า 250 เซลล์ต่อมม.3 ซึ่งถือเป็นการวินิจฉัยในเบื้องต้น (preliminary diagnosis) เมื่อผลการการเพาะเชื้อตรวจพบแบคทีเรียในสารน้ำในช่องท้อง ก็จะเป็นการยินยันการวินิจฉัยภาวะ SBP โดยในเวชปฏิบัติอาจพบผู้ป่วยที่มาด้วยอาการที่สงสัย SBP แบบไม่ตรงตามคำนิยาม เนื่องจากบางครั้งอาจมีปัจจัยอื่นๆ ที่ส่งผลกระทบต่อการวินิจฉัยและรักษา โดยมีการแบ่งกลุ่มย่อยของ SBP ตามผลตรวจน้ำในช่องท้อง ผลการเพาะเชื้อ และลักษณะทางคลินิกตามรายละเอียดในข้างต้น นอกจากนี้อาจพบภาวะ SBP ในผู้ป่วยโรคตับแข็งที่มีภาวะท้องมานโดยไม่มีอาการ เพราะฉะนั้นแพทย์ควรพึงระลึกถึงภาวะนี้เสมอและรีบดำเนินการเจาะท้องเพื่อนำสารน้ำในช่องท้องมาตรวจเพื่อค้นหาภาวะนี้แม้ผู้ป่วยอาจไม่มีอาการในระบบทางเดินอาหาร เช่น ในกรณีที่พบผู้ป่วยโรคตับแข็งที่มีภาวะท้องมานเป็นครั้งแรก หรือเป็นผู้ป่วยโรคตับแข็งที่มีภาวะท้องมานซึ่งได้รับการรักษาในโรงพยาบาล หรือพบผู้ป่วยโรคตับแข็งที่มีการทำงานของอวัยวะต่างๆ ที่แย่ลง เช่น เกิดภาวะแทรกซ้อนต่างๆ ได้แก่ โรคสมองเหตุจากโรคตับ (Hepatic encephalopathy) เลือดออกในทางเดินอาหาร มีการทำงานของไตที่แย่ลง หรือเกิด hepatorenal syndrome เป็นต้น
การตรวจทางห้องปฏิบัติการ
ในปัจจุบันการส่งสารน้ำในช่องท้องเพื่อตรวจนับจำนวนเม็ดเลือดขาวนิวโตรฟิล โดยอาจใช้วิธีการตรวจด้วย counting chamber โดยการนับมือ หรือการตรวจนับด้วยเครื่อง automated cell count หรือวิธี flow cytometry ถือเป็น gold standard ในการวินิจฉัย มีการศึกษาโดยใช้แถบตรวจปัสสาวะสำเร็จรูป (urinary reagent strip) มาเทียบเคียงว่ามีการติดเชื้อ SBP ในสารน้ำจากช่องท้องหรือไม่ พบว่าแม้การตรวจโดยใช้แถบตรวจปัสสาวะสำเร็จรูปจะมีความรวดเร็วในการช่อยคัดกรองโรค SBP แต่ยังมีความไวและความแม่นยำที่ต่ำ9 ในต่างประเทศมีการตรวจหาสาร lactoferrin ในสารน้ำในช่องท้อง (ascitic fluid lactoferrin, AFLAC) ซึ่ง lacteferrin สร้างมาจากเม็ดเลือดขาวนิวโตรฟิลโดยมีการพัฒนาการตรวจแบบ rapid test ซึ่งให้ผลเร็วและสามารถทำได้ข้างเตียงผู้ป่วยโดยไม่ต้องส่งตรวจในห้องปฎิบัติการ ซึ่งข้อมูลจากการศึกษาในต่างประเทศพบว่าการตรวจด้วยวิธีนี้มีความไวและความแม่นยำสูง10 แต่การตรวจด้วยวิธีนี้ยังขาดข้อมูลถึงระยะเวลาที่เหมาะสมในการส่งตรวจ ตลอดจนยังไม่มีการศึกษาขนาดใหญ่ยืนยันถึงตัวเลขที่เหมาะสมที่จะใช้ในการวินิจฉัยภาวะ SBP
การเจาะสารน้ำจากช่องท้องส่งตรวจ (Abdominal paracentesis)
ผู้ป่วยโรคตับแข็งที่มีภาวะท้องมาน สามารถทำการเจาะสารน้ำในช่องท้องส่งตรวจ เพื่อใช้ในการวินิจฉัยสาเหตุของท้องมานว่าเกิดจากภาวะแรงดันพอร์ทัลที่สูง หรือเกิดจากโรคของเยื่อบุช่องท้อง นอกจากนี้ยังเป็นวิธีมาตราฐานในการสืบค้นและวินิจฉัยภาวะ SBP โดยตำแหน่งที่สามารถทำการเจาะสารน้ำส่งตรวจทำได้หลายตำแหน่ง ตามความเห็นของผู้นิพนธ์แนะนำให้ทำการเจาะที่บริเวณช่องท้องส่วนล่างด้านซ้ายเนื่องจากบริเวณด้านซ้ายอาจมีโอกาสที่เข็มจะทิ่มแทงอวัยวสำคัญได้ยากกว่าด้านขวาที่มีลำไส้ใหญ่ส่วนต้น ซึ่งมีการยึดติดกับเยื่อบุช่องท้องส่วนหลัง โดยตำแหน่งที่ทำการเจาะควรเลือกตำแหน่งที่เป็น avascular infraumbilical midline เพื่อหลีกเลี่ยง inferior epigastric vessel โดยตำแหน่งที่เหมาะสมควรตรวจได้ shifting dullness เพื่อเป็นการยืนยันระดับของสารน้ำที่สามารถเจาะได้ นอกจากนี้แพทย์ควรใช้ Z เทคนิคทั้งในขณะฉีดขาชาและเจาะสารน้ำ ซึ่งเป็นการดึงผิวหนังของผู้ป่วยลงมาเล็กน้อยในขณะที่แทงเข็ม หลังจากนั้นให้ทำการปล่อยผิวหนังของผู้ป่วยไปในระนาบเดิม ก่อนที่จะแทงเข็มผ่านทะลุเยื่อบุช่องท้อง การทำ Z เทคนิคมีวัตถุประสงค์เพื่อให้ระนาบของเข็มที่ผิวหนังและในเยื่อบุช่องท้องไม่เป็นระนาบเดียวกัน เพื่อป้องกันการเกิดการรั่วของสารน้ำในช่องท้องออกมาที่ผิวหนังหลังทำการเจาะสารน้ำ ซึ่งอาจเกิดภาวะแทรกซ้อนที่นำมาซึ่งการติดเชื้อ หรือทำให้ผู้ป่วยไม่สุขสบายหลังเจาะสารน้ำได้ การเจาะสารน้ำจากช่องท้องส่งตรวจ โดยทั่วไปหากทำการเจาะอย่างถูกวิธีในผู้ป่วยโรคท้องมานระดับ 2 ขึ้นไป กล่าวคือตรวจร่างกายพบมีสารน้ำปริมาณมากพอจนตรวจได้ shifting dullness ถือเป็นหัตถการที่ปลอดภัย มีภาวะแทรกซ้อนต่ำ (น้อยกว่าร้อยละ 1)11 ถึงแม้ผู้ป่วยส่วนใหญ่จะมีความผิดปกติของค่าการแข็งตัวของเลือด อย่างไรก็ตามความเสี่ยงในการเกิดภาวะแทรกซ้อนที่รุนแรง เช่น การเจาะโดนลำไส้จนทะลุ หรือ hemoperitoneum ก็มีโอกาสเกิดได้ แพทย์จึงควรทำหัตถการด้วยความระมัดระวัง สำหรับในกรณีที่ผู้ป่วยมีค่าการแข็งตัวของเลือดผิดปกติ อาจไม่มีความจำเป็นที่จะต้องให้ส่วนประกอบของเลือด เช่น พลาสมา เกร็ดเลือด แก่ผู้ป่วยเพื่อทำการป้องกันเลือดออกทุกราย เนื่องจากยังขาดหลักฐานเชิงประจักษ์ในเรื่องของประโยชน์และความคุ้มค่า เนื่องจากการศึกษาส่วนใหญ่พบว่า ภาวะเลือดออก หรือ hemoperitoneum ที่เกิดขึ้นหลังการเจาะสารน้ำในช่องท้องส่งตรวจเกิดขึ้นได้น้อยมาก แม้ผู้ป่วยจะมีเกร็ดเลือดต่ำ หรือมีค่าการแข็งตัวของเลือดที่ผิดปกติจากโรคตับแข็ง12 ผู้นิพนธ์แนะนำให้ยึดแนวทางในการให้ส่วนประกอบของเลือดก่อนการทำหัตถการตามคำแนะนำของสมาคมโรคตับสหรัฐอเมริกา (American Association for the Study of Liver Diseases, AASLD) โดยแนะนำให้ส่วนประกอบของเลือดก่อนการทำหัตถการเฉพาะในกรณีที่ผู้ป่วยมีภาวะ hyperfibrinolysis หรือ disseminated intravascular coagulation (DIC)1 โดยข้อบ่งชี้ของการเจาะสารน้ำจากช่องท้องส่งตรวจ ได้สรุปไว้ในรูปที่ 1
การรักษา
หลักการในการรักษา SBP แบ่งออกได้เป็น
- การให้ยาปฏิชีวนะ
เมื่อพบผู้ป่วยที่สงสัยภาวะ SBP เช่น ผู้ป่วยโรคตับแข็งที่มีภาะวท้องมาน ร่วมกับมีอาการสงสัยการติดเชื้อ ท้องโตขึ้น กดเจ็บ หรือตรวจเลือดพบเม็ดเลือดขาวสูงผิดปกติ หรือมีการทำงานของไตที่แย่ลง แพทย์ควรทำการให้ยาปฏิชีวนะทางเส้นเลือดให้เร็วที่สุด (empirical treatment) เนื่องจากหากให้การรักษาไม่ทันท่วงที จะส่งผลให้อัตราการเสียชีวิตของผู้ป่วยเพิ่มขึ้น โดยยากลุ่ม third-generation, broad-spectrum cephalosporins ถือเป็นยาที่ผู้เชี่ยวชาญแนะนำให้เลือกพิจารณาเป็นตัวแรก ในกรณีที่สงสัย CA-SBP โดยไม่จำเป็นต้องรอผลเพาะเชื้อจากสารน้ำในช่องท้อง โดยแนะนำให้พิจารณาเลือกใช้ยา cefotaxime ขนาด 2 กรัม ทุก 8 ชั่วโมง เป็นเวลา 5 วัน1 กรณีที่ผู้ป่วยแพ้ยา penicillin อาจพิจารณาให้ยากลุ่ม fluoroquinolone นอกจากนี้หากพิจารณาแล้วพบว่า ผู้ป่วย SBP มีอาการไม่รุนแรง เช่น ไม่มีลักษณะของ sepsis อาจเลือกให้การรักษาด้วยยากลุ่ม fluoroquinolone ชนิดรับประทาน โดยแนะนำยาที่มี oral bioavailability สูง เช่น ciprofloxacin หรือ levofloxacin13 สำหรับในกรณีที่สงสัย N-SBP หรือ HCA-SBP ให้พิจารณาเลือก empirical treatment ตามหลักการของโรคติดเชื้อ รูปที่ 2 แสดงถึงแนวทางในการรักษา SBP ด้วยยาปฏิชีวนะในสถาณการณ์ต่างๆ
- การรักษาด้วยแอลบูมิน
แอลบูมินเป็นโปรทีนชนิด single chain peptide ที่สังเคราะห์จากตับโดยมีค่าครึ่งชีวิตเฉลี่ย 21 วัน โดยหน้าที่สำคัญของแอลบูมินคือช่วยในการควบคุม oncotic pressure ขนส่งฮอร์โมน กรดไขมัน ยา โลหะหนัก และสารต่างๆ ตลอดจนช่วยในการกำจัดอนุมูนอิสระ14 ข้อมูลจากการศึกษาพบว่า ผู้ป่วยโรคตับแข็งส่วนใหญ่จะมีการสร้างแอลบูมินที่ลดลงและมีรูปร่างที่ผิดปกติ ซึ่งจะส่งผลต่อการเพิ่มอัตราการเจ็บป่วยและอัตราการเสียชีวิตแก่ผู้ป่วย15 นอกจากนี้การพิจารณาให้แอลบูมินร่วมกับยาปฎิชีวนะในการรักษา SBP อาจได้ประโยชน์มากขึ้น ข้อมูลจากการศึกษาแบบสุ่มพบว่าการรักษา SBP ด้วยยา cefotaxime ร่วมกับ แอลบูมินขนาด 1.5 กรัม ต่อ น้ำหนักตัว 1 กิโลกรัม ภายใน 6 ชั่วโมงหลังวินิจฉัย SBP ตามด้วยขนาด 1 กรัม ต่อ น้ำหนักตัว 1 กิโลกรัม ในวันที่ 3 สามารถลดอัตราการเสียชีวิตทั้งในระหว่างนอนโรงพยาบาล และที่ 3 เดือนหลังติดตามการรักษา นอกจากนี้ผู้ป่วยที่ได้แอลบูมินยังสามารถชะลอการเสื่อมของไต16 อย่างไรก็ตาม การศึกษานี้ไม่ได้เป็นการศึกษาแบบสุ่มที่มีการปกปิด (double blind study) และมีผู้ป่วยบางกลุ่มเท่านั้นที่มีการศึกษายืนยันว่าอาจได้ประโยชน์จากแอลบูมิน (serum creatinine > 1 มก/ดล, bilirubin >4 มก/ดล. และ BUN >30 มก/ดล)17 และแอลบูมินยังมีราคาแพง จึงควรพิจารณาให้ร่วมกับยาปฎิชีวนะเป็นรายๆ ไป
- SBP กับการพิจารณาปลูกถ่ายตับ (liver transplantation)
ผู้ป่วย SBP ไม่ถือเป็นข้อห้ามในการปลูกถ่ายตับ อย่างไรก็ตามหากผู้ป่วยเกิด SBP แพทย์ผู้ดูแลควรพิจารณาส่งผู้ป่วยไปขึ้นทะเบียนเพื่อรอรับการผ่าตัดปลูกถ่ายตับ เนื่องจากภายหลังจากการเกิด SBP ผู้ป่วยมักจะมีการดำเนินโรคที่แย่ลงและเพิ่มอัตราการเสียชีวิตแก่ผู้ป่วย
การป้องกัน
การป้องกันการเกิด SBP แบ่งได้เป็น
- การป้องกันโรคระดับปฐมภูมิ (primary prophylaxis)
ผู้ป่วยโรคตับแข็งที่มีภาวะท้องมาน สมควรพิจารณาติดตามระดับโปรทีนและแอลบูมินของสารน้ำในช่องท้อง โดยผู้ป่วยที่มี ascitic fluid protein <1 กรัม/ดล. ควรได้รับการพิจารณาให้รับประทาน norfloxacin ขนาด 400 มก. วันละครั้งเพื่อป้องกันการเกิด SBP เนื่องจากมีหลักฐานทางการแพทย์มากที่สุด โดยข้อมูลจากการวิเคราะห์อภิมาน (meta-analysis) พบว่าการให้ยาปฎิชิวนะสามารถป้องกันการเกิด SBP และผู้ป่วยมีอัตราการรอดชีวิตที่ 3 เดือน มากกว่าผู้ป่วยที่ไม่ได้ยาปฏิชีวนะ18 โดยข้อมูลที่ได้จากการศึกษาไปข้างหน้าแบบสุ่มปกปิดทั้ง 2 ฝ่าย (double-blind, placebo-controlled trial) พบว่าผู้ป่วยโรคตับแข็งที่มีภาวะท้องมานและมี ascitic fluid protein <1 กรัม/ดล. ร่วมกับข้อใดข้อหนึ่งดังต่อไปนี้ ได้แก่ advanced cirrhosis (Child score ตั้งแต่ 9 คะแนนขึ้นไป), serum creatinine ตั้งแต่ 1.2 มก./ดล., BUN ตั้งแต่ 25 มก./ดล. หรือ serum sodium น้อยกว่าหรือเท่ากับ130 มิลลิอิควิวาเลนต์/ลิตร หากได้รับยา norfloxacin ขนาด 400 มก. รับประทาน วันละครั้ง พบว่าผู้ป่วยกลุ่มที่ได้รับประทานยาสามารถมีอัตราการรอดชีวิตที่ 3 เดือน และ 1 ปี สูงกว่ากลุ่มที่ไม่ได้รับประทานยาอย่างมีนัยสำคัญทางสถิติ นอกจากนี้เมื่อติดตามผู้ป่วยที่ 1 ปี พบว่า ผู้ป่วยที่รับประทานยาสามารถลดความเสี่ยงในการเกิด hepatorenal syndrome และ SBP อย่างมีนัยสำคัญทางสถิติ19 ล่าสุดได้มีการศึกษาไปข้างหน้าแบบสุ่มปกปิดทั้ง 2 ฝ่าย (double-blind, placebo-controlled trial) ขนาดใหญ่ยืนยันประโยชน์ของการให้ยา norfloxacin ขนาด 400 มก. รับประทาน วันละครั้ง ในผู้ป่วยโรคตับแข็งที่มีภาวะท้องมานและมี ascitic fluid protein <1.5 กรัม/ดล. พบว่าสามารถลดอัตราการสียชีวิตที่ 6 เดือน เมื่อเทียบกับกลุ่มที่ได้ยาหลอก โดยเป็นที่น่าสนใจว่าในระหว่างที่มีการติดตามการรักษาไป 1 ปีหลังเริ่มยา ไม่พบว่าการให้ยา norfloxacin ขนาด 400 มก. รับประทาน วันละครั้ง สัมพันธ์กับการเกิดเชื้อแบคทีเรียดื้อยาที่เพิ่มขึ้น20 โดยยาปฏิชีวนะชนิดอื่นที่อาจพิจารณาเป็นทางเลือกในการป้องกันการเกิด SBP ได้แก่ ยา ciprofloxacin ยา trimethoprim–sulfamethoxazole และยา rifaximin นอกจากนี้ ผู้ป่วยโรคตับแข็งที่มีเลือดออกในทางเดินอาหาร แม้จะตรวจไม่พบภาวะท้องมาน ก็ควรพิจารณาให้ยาปฎิชีวนะในขนาดป้องกันการเกิด SBP และการติดเชื้ออื่นๆ
- การป้องกันโรคระดับทุติยภูมิ (secondary prophylaxis)
ผู้ป่วยโรคตับแข็งที่เคยได้รับการวินิจฉัย SBP ควรได้ยาปฏิชีวนะรับประทานเพื่อป้องกันการเกิด SBP ไปตลอดชีวิตจนกว่าจะได้รับการผ่าตัดปลูกถ่ายตับ หรือหายจากภาวะท้องมาน เนื่องจากผู้ป่วยมักจะเกิดการติดเชื้อซ้ำได้บ่อยโดยเฉลี่ยร้อยละ 43 ภายในระยะเวลา 6 เดือนหลังวินิจฉัย SBP21 โดยแนะนำให้พิจารณายา norfloxacin ขนาด 400 มก. รับประทาน วันละครั้ง เป็นตัวแรก เนื่องจากมีการศึกษาถึงประสิทธิภาพและความปลอดภัยของยา โดยข้อมูลที่ได้จากการศึกษาไปข้างหน้าแบบสุ่มปกปิดทั้ง 2 ฝ่าย (double-blind, placebo-controlled trial) พบว่า ผู้ป่วยที่ได้รับยา norfloxacin ขนาด 400 มก. รับประทาน วันละครั้ง มีอัตราการเกิด SBP ซ้ำที่ 1 ปี (ร้อยละ 20) น้อยกว่าผู้ป้วยที่ได้ยาหลอก (ร้อยละ 68) อย่างมีนัยสำคัญทางสถิติ22 โดยยา ciprofloxacin และ ยา trimethoprim–sulfamethoxazole อาจพิจารณาเป็นตัวเลือกในการรักษาได้เช่นเดียวกัน
- การให้คำแนะนำทางด้านโภชนาการ
ผู้ป่วยโรคตับแข็งที่ได้รับการวินิจฉัย SBP มีความเสี่ยงในการเกิดภาวะทุพโภชนาการ ซึ่งจะส่งผลต่ออัตราการอยู่รอดของผู้ป่วย แพทย์ควรแนะนำให้ผู้ป่วยบริโภคโปรทีนให้เพียงพอโดยเฉลี่ยวันละ 1.2 ถึง 1.5 กรัมต่อน้ำหนักตัว โดยอาจพิจารณาแบ่งอาหารเป็นมื้อย่อยๆ 4 ถึง 6 มื้อ23 โดยเพิ่มอาหารว่างก่อนนอนที่มีส่วนประกอบของคาร์โบไฮเดรตสูง (carbohydrate‐rich snack)24 เพื่อหลีกเลี่ยงอาการแน่นท้อง โดยแนะนำให้จำกัดการบริโภคเกลือเพื่อช่วยควบคุมภาวะท้องมานและลดบวม ผู้ป่วยควรหลีกเลี่ยงอาหารดิบ อาหารที่ไม่ปรุงสุกหรือผ่านความร้อนที่เพียงพอ เนื่องจากอาจเสี่ยงต่อการติดเชื้อแบคทีเรียในกระแสเลือดที่รุนแรงถึงแก่ชีวิต สำหรับ probiotics ไม่มีข้อมูลขนาดใหญ่ยืนยันว่าได้ประโยชน์ในการรักษาและป้องกันการเกิด SBP
รูปที่ 1 ข้อบ่งชี้ในการเจาะสารน้ำในช่องท้องส่งตรวจในผู้ป่วยท้องมานเพื่อการวินิจฉัย*

*ดัดแปลงจาก Runyon BA. American Association for the Study of Liver Diseases (AASLD) Practice Guidelines Committee. Management of Adult Patients with Ascites Due to Cirrhosis: Update 2012.
รูปที่ 2 แนวทางในการรักษา spontaneous bacterial peritonitis ด้วยยาปฏิชีวนะในสถานะการณ์ต่างๆ
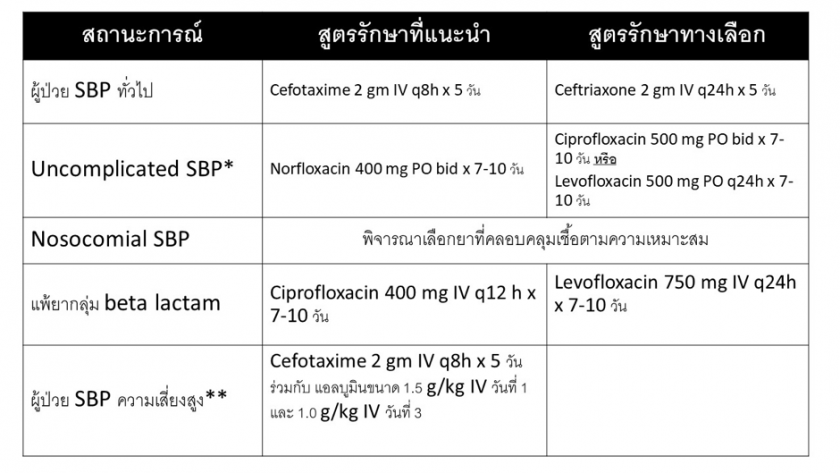
*Uncomplicated SBP หมายถึง community acquired SBP ที่ไม่มีภาวะชอค, intestinal ileus เลือดออกในทางเดินอาหาร, hepatic encephalopathy และ serum creatinine >3 มก/ดล
**ผู้ป่วย SBP ความเสี่ยงสูง หมายถึง ผู้ป่วย SBP ที่มี advanced liver หรือ renal failure ได้แก่ ตรวจพบ serum creatinine >1 มก/ดล. BUN >30 มก/ดล. หรือ total bilirubin >4 มก/ดล.
บรรณานุกรม
- Runyon BA. Introduction to the revised American Association for the Study of Liver Diseases Practice Guideline management of adult patients with ascites due to cirrhosis 2012. Hepatology 2013;57:1651-3.
- Chirapongsathorn S, Poovorawan K, Soonthornworasiri N, Pan-ngum W, Phaosawasdi K, Treeprasertsuk S. Thirty-Day Readmission and Cost Analysis in Patients With Cirrhosis: A Nationwide Population-Based Data. Hepatology Communications 2020;4:453-60.
- Hurwich DB, Lindor KD, Hay JE, Gross JB, Jr., Kaese D, Rakela J. Prevalence of peritonitis and the ascitic fluid protein concentration among chronic liver disease patients. Am J Gastroenterol 1993;88:1254-7.
- Dever JB, Sheikh MY. Review article: spontaneous bacterial peritonitis – bacteriology, diagnosis, treatment, risk factors and prevention. Alimentary Pharmacology & Therapeutics 2015;41:1116-31.
- Rimola A, García-Tsao G, Navasa M, et al. Diagnosis, treatment and prophylaxis of spontaneous bacterial peritonitis: a consensus document. Journal of Hepatology 2000;32:142-53.
- Runyon BA, Squier S, Borzio M. Translocation of gut bacteria in rats with cirrhosis to mesenteric lymph nodes partially explains the pathogenesis of spontaneous bacterial peritonitis. J Hepatol 1994;21:792-6.
- Scarpellini E, Valenza V, Gabrielli M, et al. Intestinal permeability in cirrhotic patients with and without spontaneous bacterial peritonitis: is the ring closed? Am J Gastroenterol 2010;105:323-7.
- Friedrich K, Nüssle S, Rehlen T, Stremmel W, Mischnik A, Eisenbach C. Microbiology and resistance in first episodes of spontaneous bacterial peritonitis: implications for management and prognosis. J Gastroenterol Hepatol 2016;31:1191-5.
- Nousbaum JB, Cadranel JF, Nahon P, et al. Diagnostic accuracy of the Multistix 8 SG reagent strip in diagnosis of spontaneous bacterial peritonitis. Hepatology 2007;45:1275-81.
- Parsi MA, Saadeh SN, Zein NN, et al. Ascitic fluid lactoferrin for diagnosis of spontaneous bacterial peritonitis. Gastroenterology 2008;135:803-7.
- Runyon BA. Paracentesis of ascitic fluid. A safe procedure. Arch Intern Med 1986;146:2259-61.
- Pache I, Bilodeau M. Severe haemorrhage following abdominal paracentesis for ascites in patients with liver disease. Aliment Pharmacol Ther 2005;21:525-9.
- Turnidge J. Pharmacokinetics and pharmacodynamics of fluoroquinolones. Drugs 1999;58 Suppl 2:29-36.
- Garcia-Martinez R, Caraceni P, Bernardi M, Gines P, Arroyo V, Jalan R. Albumin: pathophysiologic basis of its role in the treatment of cirrhosis and its complications. Hepatology 2013;58:1836-46.
- Jalan R, Schnurr K, Mookerjee RP, et al. Alterations in the functional capacity of albumin in patients with decompensated cirrhosis is associated with increased mortality. Hepatology 2009;50:555-64.
- Sort P, Navasa M, Arroyo V, et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. N Engl J Med 1999;341:403-9.
- Sigal SH, Stanca CM, Fernandez J, Arroyo V, Navasa M. Restricted use of albumin for spontaneous bacterial peritonitis. Gut 2007;56:597-9.
- Saab S, Hernandez JC, Chi AC, Tong MJ. Oral antibiotic prophylaxis reduces spontaneous bacterial peritonitis occurrence and improves short-term survival in cirrhosis: a meta-analysis. Am J Gastroenterol 2009;104:993-1001; quiz 2.
- Fernández J, Navasa M, Planas R, et al. Primary prophylaxis of spontaneous bacterial peritonitis delays hepatorenal syndrome and improves survival in cirrhosis. Gastroenterology 2007;133:818-24.
- Moreau R, Elkrief L, Bureau C, et al. Effects of Long-term Norfloxacin Therapy in Patients With Advanced Cirrhosis. Gastroenterology 2018;155:1816-27.e9.
- Titó L, Rimola A, Ginès P, Llach J, Arroyo V, Rodés J. Recurrence of spontaneous bacterial peritonitis in cirrhosis: frequency and predictive factors. Hepatology 1988;8:27-31.
- Ginés P, Rimola A, Planas R, et al. Norfloxacin prevents spontaneous bacterial peritonitis recurrence in cirrhosis: Results of a double-blind, placebo-controlled trial. Hepatology 1990;12:716-24.
- Nompleggi DJ, Bonkovsky HL. Nutritional supplementation in chronic liver disease: an analytical review. Hepatology 1994;19:518-33.
- O’Brien A, Williams R. Nutrition in end-stage liver disease: principles and practice. Gastroenterology 2008;134:1729-40.
Tags: Cirrhosis and PHT




