การรักษามะเร็งตับเฉพาะที่โดยไม่ผ่าตัด
Locoregional Treatment of Hepatocellular Carcinoma
ผศ.พญ.ณัชชา ปิ่นเจริญ
หน่วยรังสีร่วมรักษา สาขารังสีวิทยาวินิฉัย ภาควิชารังสีวิทยา คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย
วันที่ 19 กรกฎาคม 2567
มะเร็งตับเป็นมะเร็งที่พบบ่อยในประเทศไทย และเป็นสาเหตุการตายอันดับ 1 ของมะเร็งทั้งหมด โดยเป็นมะเร็งที่พบมากเป็นอันดับ 1
ในเพศชาย และพบมากเป็นอันดับต้นๆในเพศหญิง โดยทั่วไปเมื่อพูดถึงก้อนมะเร็งในตับ สามารถเป็นได้ทั้ง
- มะเร็งตับชนิดปฐมภูมิ คือ มะเร็งของเซลล์ตับ (Hepatocellular carcinoma) หรือเรียกว่า HCC
- มะเร็งของท่อน้ำดี (Cholangiocarcinoma)
- มะเร็งตับชนิดทุติยภูมิ คือ มะเร็งที่ลุกลามมาจากมะเร็งของอวัยวะอื่น หรือ เรียกว่า Liver metastases
ภาพรวมทางเลือกของการรักษามะเร็งตับ HCC ในปัจจุบัน(1) ประกอบด้วยการรักษาหลายวิธี ได้แก่
- การรักษาด้วยการผ่าตัด
1.1 การผ่าตัดเอาก้อนมะเร็งออก (Hepatic resection) เป็นการรักษาแบบหวังผลหายขาด (curative treatment) หลักที่สำคัญในผู้ป่วยมะเร็งตับ อย่างไรก็ดีผู้ป่วยมะเร็งตับส่วนมากมักมาพบแพทย์ในระยะที่ไม่สามารถผ่าตัดได้ มีเพียงประมาณร้อยละ 25-30 ที่สามารถเข้ารับการผ่าตัดได้ตั้งแต่ได้รับการวินิจฉัยโดยข้อจำกัดหลักที่ทำให้ผู้ป่วยไม่สามารถรับการผ่าตัด ได้แก่ การกระจายตัว ขนาดและขอบเขตของก้อนมะเร็ง ตลอดจนปริมาตรและการทำงานของตับที่จะเหลืออยู่ (future liver remnant, FLR) ของผู้ป่วยแต่ละรายโดยเฉพาะในกรณีที่มีภาวะตับแข็ง (liver cirrhosis) หรือ มีโรคประจำตัวที่เป็นความเสี่ยงสูงในการผ่าตัด เป็นต้น
1.2 การผ่าตัดปลูกถ่ายตับ (Liver transplantation) ซึ่งสามารถพิจารณาการรักษาได้ในกรณีที่พบมะเร็งตับระยะแรก หรือเมื่อควบคุมโรคให้อยู่ใน Milan’s criteria และไม่มีการแพร่กระจายออกนอกตับ โดยถือเป็นการรักษาทั้งมะเร็งตับและภาวะตับแข็งไปพร้อมกัน นับเป็นทางเลือกการรักษาที่ดีที่สุดในปัจจุบัน - การรักษามะเร็งตับโดยการทำลายก้อนมะเร็งเฉพาะที่โดยตรง (Locoregional treatment หรือ Liver-directed therapies) เป็นทางเลือกหลักในการรักษาผู้ป่วยมะเร็งตับที่ไม่สามารถผ่าตัดจากสาเหตุต่างๆ รวมทั้งมะเร็งกลับเป็นซ้ำหลังผ่าตัด โดยผู้ป่วยต้องมีสภาพร่างกายและภาวการณ์ทำงานของตับดีพอสมควร ประกอบด้วยการรักษา 2 รูปแบบ คือ
2.1 การจี้ทำลายก้อนมะเร็งเฉพาะที่ (Tumor ablation) เป็นการใช้เข็มจี้ชนิดต่างๆแทงเข้าไปยังก้อนมะเร็งโดยตรง แล้วอาศัยเทคโนโลยีในการทำลายเนื้อเยื่อรอบๆปลายเข็ม สามารถรักษาได้ด้วยการแทงเข็มผ่านผิวหนังบริเวณท้องไปยังก้อนในตับ (Percutaneous tumor ablation) โดยอาศัยภาพ ultrasound หรือ CT scan นำทาง หรืออาจใช้การจี้ทำลายก้อนมะเร็งร่วมกับการผ่าตัด หรือผ่าตัดส่องกล้องก็ได้เช่นกันPercutaneous tumor ablation เป็นการรักษาที่มีประสิทธิภาพสูงและหวังผลหายขาด (curative treatment) ในก้อนมะเร็งขนาดเล็ก ไม่เกิน 2-3 เซนติเมตร สามารถใช้รักษาได้ทั้งมะเร็งตับ HCC และ มะเร็งที่ลุกลามมาจากมะเร็งของอวัยวะอื่น (Liver metastases) ซึ่งเป็นการรักษาแบบรุกล้ำน้อย (minimally-invasive treatment) ระยะพักฟื้นสั้นมาก โอกาสเกิดภาวะแทรกซ้อนต่ำมาก แทบไม่กระทบการทำงานโดยรวมของตับ และสามารถรักษาซ้ำได้ง่ายในกรณีที่มีก้อนมะเร็งเกิดขึ้นมาใหม่
2.2 การรักษามะเร็งผ่านทางหลอดเลือดแดงของตับ (Transarterial treatment) ซึ่งทำโดยการให้ยาเคมีบำบัด หรือวัสดุทางการแพทย์เพื่อการรักษาผ่านทางทางสายสวนหลอดเลือดขนาดเล็ก (microcatheter) เข้าไปในหลอดเลือดแดงที่เลี้ยงก้อนมะเร็งโดยตรง เนื่องจากมะเร็งตับ HCC เป็นมะเร็งที่มีหลอดเลือดแดงมาเลี้ยงมาก (hypervascular tumor) โดยได้รับเลือดส่วนใหญ่มาจากแขนงของหลอดเลือดแดงตับ (hepatic artery) ดังนั้นการให้รักษาก้อนมะเร็งผ่านทาง hepatic artery จึงได้ผลการรักษาดี และมีผลข้างเคียงต่อเนื้อตับปกติน้อย เนื่องจากเนื้อตับปกติได้รับเลือดส่วนใหญ่มาจาก portal vein เป็นทางเลือกหลักในการรักษาผู้ป่วยมะเร็งตับ HCC ที่ไม่สามารถผ่าตัดได้ และมีก้อนขนาดใหญ่ หรือมีก้อนในตับหลายตำแหน่ง หรือเป็นการรักษาระหว่างเตรียมความพร้อมก่อนการผ่าตัด หรือมะเร็งกลับเป็นซ้ำหลังผ่าตัด - การมะเร็งตับ HCC ด้วยยา Systemic therapy ซึ่งในปัจจุบันมียากลุ่ม Targeted therapy และ Immunotherapy เป็นวิธีการรักษาหลักในผู้ป่วยมะเร็งระยะลุกลาม มะเร็งระยะแพร่กระจายออกนอกตับ มะเร็งตับที่ไม่สามารถรักษาด้วยการผ่าตัดหรือ locoregional treatment และมะเร็งที่ไม่ตอบสนองต่อการรักษาด้วยวิธีอื่น ทั้งนี้ผู้ป่วยต้องมีสภาพร่างกายและการทำงานของตับดีพอสมควรจึงจะได้ประโยชน์จากการรักษา
- การรักษาแบบประคับประคอง (Palliative treatment หรือ Best supportive care) เป็นการรักษาตามอาการเพื่อดูแลสภาพร่างกายและบรรเทาความเจ็บปวด รวมทั้งรักษาภาวะแทรกซ้อนจากโรคมะเร็งหรือภาวะตับแข็ง ในกรณีที่ผู้ป่วยที่มีสภาพการทำงานของร่างกายและตับอ่อนแอจนอาจเป็นอันตรายจากการรักษาวิธีต่างๆข้างต้น หรือผู้ป่วยเป็นมะเร็งตับระยะลุกลามจนไม่อาจสามารถรักษาหรือควบคุมโรคได้
บทความต่อจากนี้ จะกล่าวถึงรายละเอียดการรักษามะเร็งตับ HCC ด้วย locoregional treatment หรือ Liver-directed therapies วิธีต่างๆที่มีในประเทศไทย และสามารถเพิ่มอัตราการรอดชีวิตของผู้ป่วยได้
การจี้ทำลายก้อนมะเร็งเฉพาะที่ผ่านทางผิวหนัง (Percutaneous Tumor Ablation)
การจี้ทำลายก้อนมะเร็งเฉพาะที่ (Tumor ablation) ด้วยความร้อน
การจี้ทำลายก้อนมะเร็งเฉพาะที่ด้วยความร้อนผ่านทางผิวหนัง (Percutaneous tumor ablation) ต้องอาศัยภาพรังสีเช่น ultrasound หรือ CT scan เพื่อระบุตำแหน่งและขนาดของก้อนมะเร็งเพื่อวางแผนการรักษา มีข้อเด่นคือการทำลายเนื้อเยื่อทั้งก้อนและรวมถึงเนื้อเยื่อปกติประมาณ 0.5-1.0 เซนติเมตรรอบก้อน (รูปที่ 1.) ทำให้ได้ผลการรักษาดีเทียบเคียงการผ่าตัดในก้อนมะเร็งขนาดไม่เกิน 2-3 เซนติเมตร(2-4)โดยการรักษาจะมีประสิทธิภาพลดลงเมื่อก้อนขนาดใหญ่ขึ้น(5) หรือก้อนอยู่ติดกับหลอดเลือดขนาดใหญ่ที่จะระบายความร้อนของเนื้อเยื่อทำให้อุณหภูมิไม่สูงพอ (heat sink effect)(6)หรือก้อนอยู่ในตำแหน่งที่ความร้อนอาจทำให้เกิดอันตราย เช่น ก้อนอยู่ใกล้ท่อน้ำดี ถุงน้ำดี ลำไส้ กระบังลม และหัวใจ เป็นต้น
การจี้ทำลายก้อนมะเร็งเฉพาะที่ด้วยความร้อน เป็นวิธี tumor ablation ที่ถูกใช้มากที่สุด และเป็นการรักษาแบบหวังผลขายขาดของมะเร็งตับ HCC ขนาดเล็กไม่เกน 3 เซนติเมตร(4) โดยหลักการในการเลือกวิธีการรักษาระหว่าง tumor ablation หรือ การผ่าตัด นอกจากขนาดของก้อนแล้ว ยังขึ้นกับ ตำแหน่งของก้อน, hepatic reserve และ patient comorbidity.
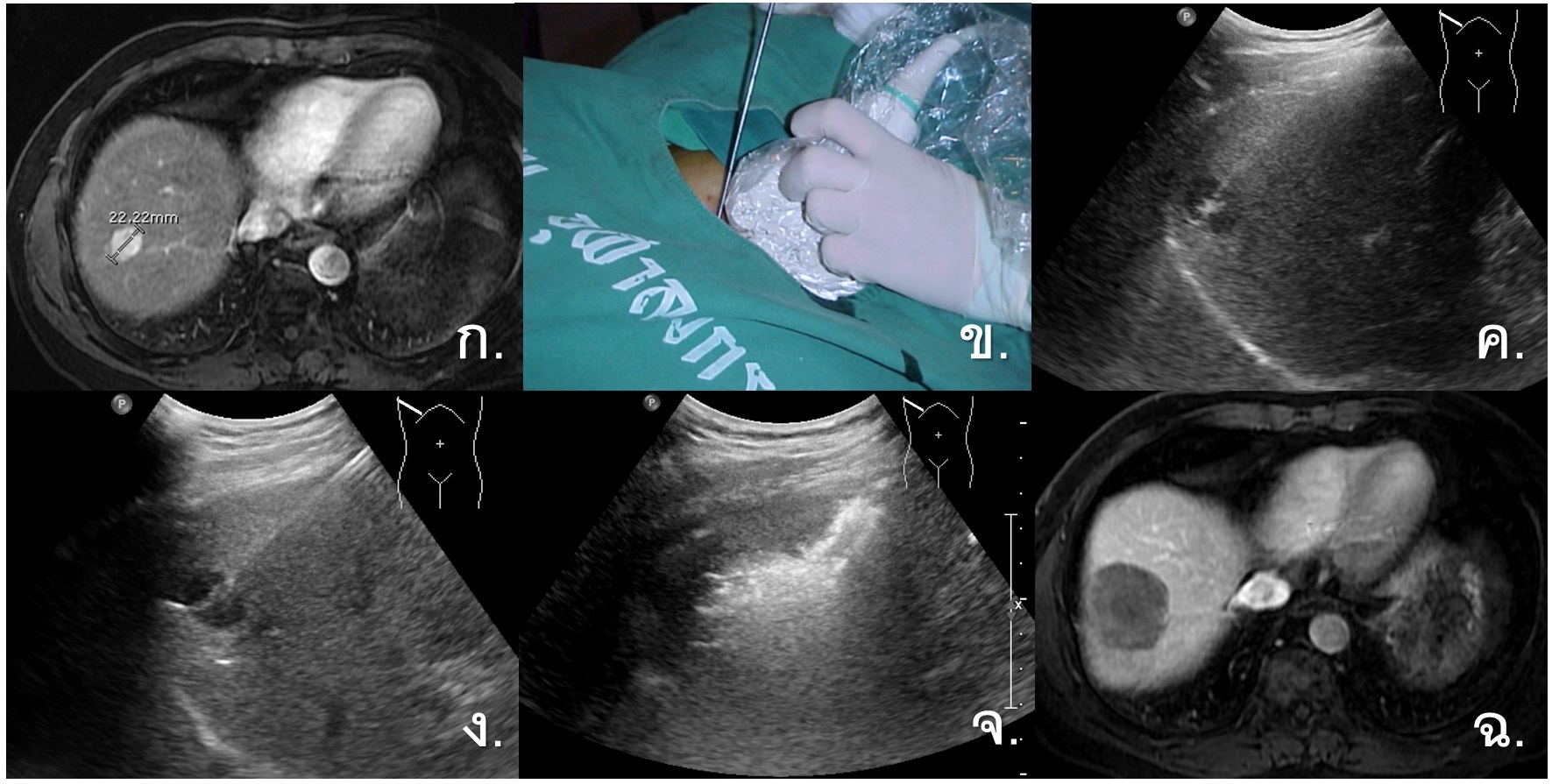
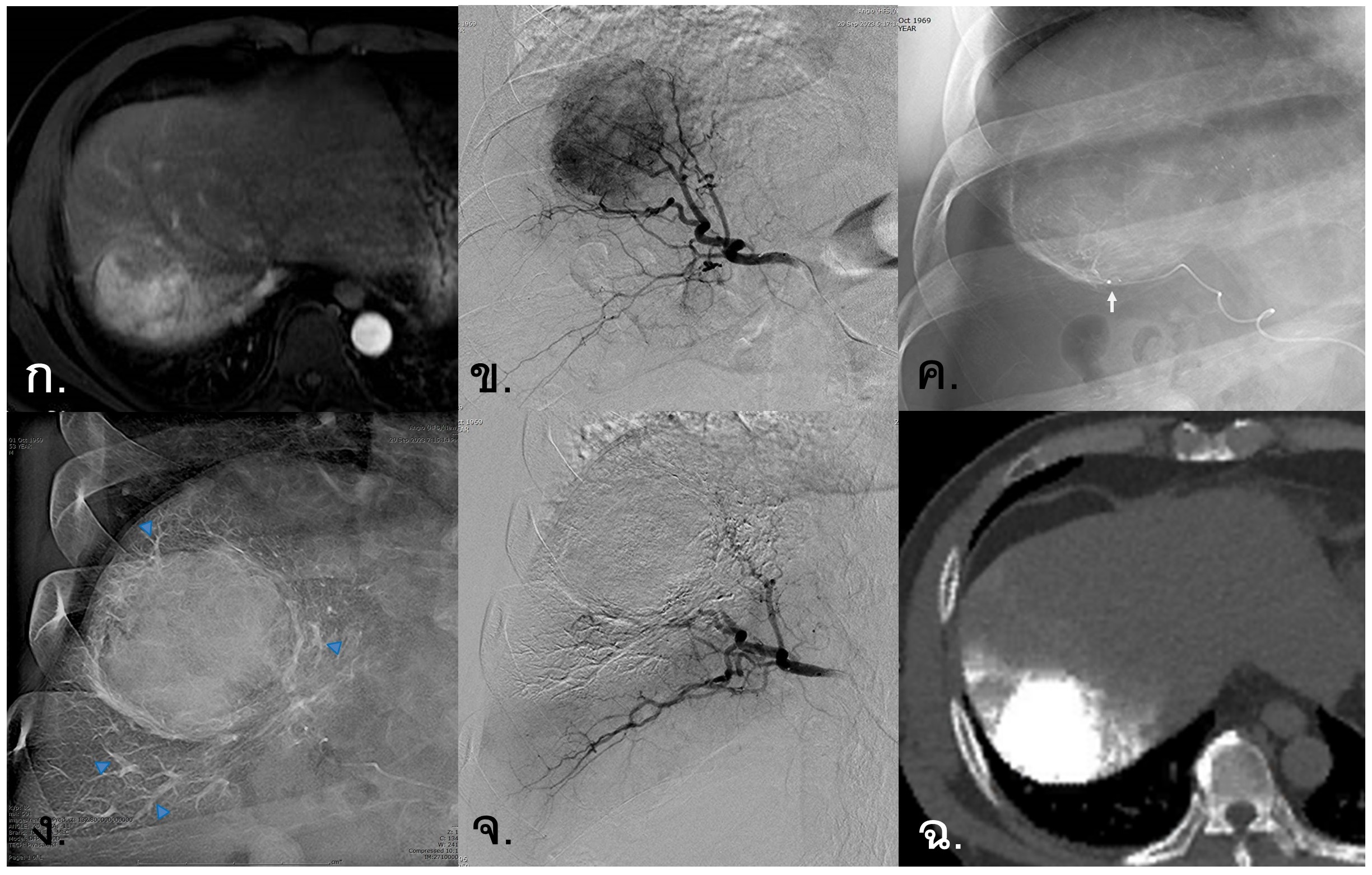
รูปที่ 1- Percutaneous Radiofrequency Ablation. ก. ภาพ MRI arterial-phase พบว่ามีก้อนมะเร็งตับขนาด 2.2 เซนติเมตรที่ right hepatic dome, ข.-ง. ภาพแสดงการรักษาด้วย Percutaneous tumor ablation โดยใช้ ultrasound นำทางในการแทงเข็ม, จ. ขณะทำการรักษา บริเวณเนื้อเยื่อที่ได้รับความร้อนจะเปลี่ยนเป็น hyperechogenicity, ฉ. ภาพ MRI venous-phase หลังการรักษา 1 เดือน แสดงให้เห็นถึงก้อนมะเร็งและเนื้อเยื่อโดยรอบที่ถูกทำลายเป็น non-enhancing area
ในปัจจุบันเทคโนโลยีเพื่อทำให้เกิดความร้อนที่ใช้แพร่หลายในประเทศไทย มี 2 วิธี คือ Radiofrequency ablation (RFA) และ Microwave ablation (MWA) ซึ่ง MWA ทำลายเนื้องอกด้วยอุณหภูมิที่สูงกว่า ได้ ablation zone กว้างกว่า สามารถพิจารณาใช้รักษาก้อนที่มีขนาด≤ 4 เซนติเมตร(1) ลดโอกาสเกิด heat sink effect และใช้เวลาในการรักษาสั้นกว่า RFA อย่างไรก็ดี ทั้ง 2 วิธีถือว่าให้ผลการรักษาโดยรวม อัตราการรอดชีวิต และโอกาสเกิดภาวะแทรกซ้อนไม่แตกต่างกันอย่างมีนัยสำคัญ(7)
ในกรณีที่ก้อนมะเร็งตับ single tumor ขนาด 3-5 เซนติเมตรควรพิจารณาการรักษาด้วยการผ่าตัดเป็นวิธีแรก ในกรณีที่ไม่สามารถผ่าตัดได้อาจพิจารณาการรักษาด้วย Tumor ablation ร่วมกับ Transarterial Chemoembolization (TACE) เพื่อให้ได้ประสิทธิภาพในการรักษาที่ดีขึ้น(8, 9) (รูปที่ 2.)
ส่วนในกรณีที่ก้อนอยู่ในตำแหน่งที่ไม่เหมาะสมต่อการจี้ด้วยความร้อน อาจจะพิจารณาการจี้ก้อนมะเร็งด้วยวิธีอื่นที่จะกล่าวถึงต่อไป หรือ การจี้ทำลายก้อนมะเร็งร่วมกับการผ่าตัดแบบส่องกล้อง (laparoscopic tumor ablation) หรือ การรักษาผ่านทางหลอดเลือดแดง (transarterial treatment)
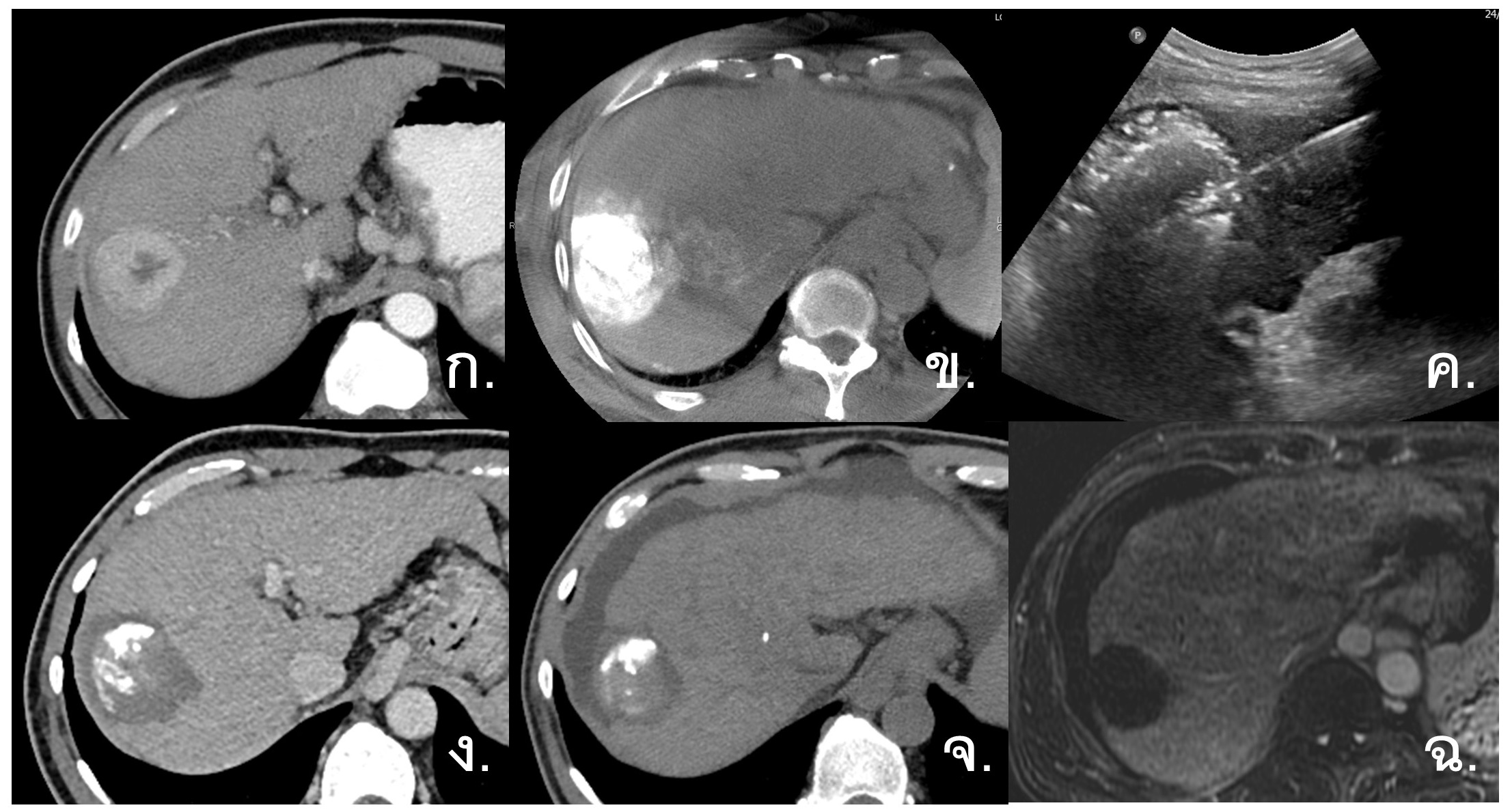
รูปที่ 2- Combined TACE with Microwave Ablation. ก. ภาพ CT arterial-phase พบว่ามีก้อนมะเร็งตับขนาด 4.2 เซนติเมตรที่ right hepatic lobe, ข. ภาพ Cone beam CT เห็นยา Lipiodol เป็น hyperdensity จับเต็มก้อนมะเร็งหลังการรักษาด้วย TACE, ค. ภาพแสดงการรักษาด้วย percutaneous tumor ablation ซ้ำที่ก้อนมะเร็งโดยใช้ ultrasound นำทาง, ง. ภาพ CT venous-phase หลังการรักษา 5 เดือน เห็นก้อนมะเร็งและเนื้อเยื่อโดยรอบที่ถูกทำลายเป็น non-enhancing area ร่วมกับมี Lipiodol อยู่ภายใน, จ. ภาพ non-contrast CT หลังการรักษา 3 ปี, ฉ. ภาพ MRI venous-phase หลังการรักษา 3 ปี ไม่พบ recurrence tumor (complete response)
การจี้ทำลายก้อนมะเร็งเฉพาะที่ด้วยความเย็น (Cryoablation)
การจี้ทำลายก้อนเนื้องอกเฉพาะที่ด้วยความเย็นสามารถพิจารณาเป็นทางเลือกในการรักษาก้อนมะเร็งขนาด≤ 4 เซนติเมตร(10) นอกจากนี้ยังอาจใช้ทดแทน RFA หรือ MWA ที่กรณีที่ก้อนอยู่ในตำแหน่งที่ไม่เหมาะสมต่อการจี้ด้วยเข็มความร้อน(10, 11) เช่น ก้อนอยู่ใกล้หลอดเลือด ใกล้ท่อน้ำดี ชิดผิวตับ ใกล้อวัยวะข้างเคียง ได้แก่ ถุงน้ำดี ลำไส้ ต่อมหมวกไต กระบังลม หรือหัวใจ เป็นต้น โดยทำให้เกิดความเย็นกลายเป็น ice ball บริเวณรอบปลายเข็ม ซึ่งจะสามารถเห็นขอบเขตของ ice ball ได้ด้วย non-contrast CT scan ขณะทำการรักษา (รูปที่ 3.) การรักษาด้วย Cryoablation มีราคาสูงกว่าการรักษาด้วยเข็มความร้อน และอาจต้องใช้เข็มความเย็นมากกว่า 1 เข็มทั้งนี้ขึ้นกับขนาดของก้อน
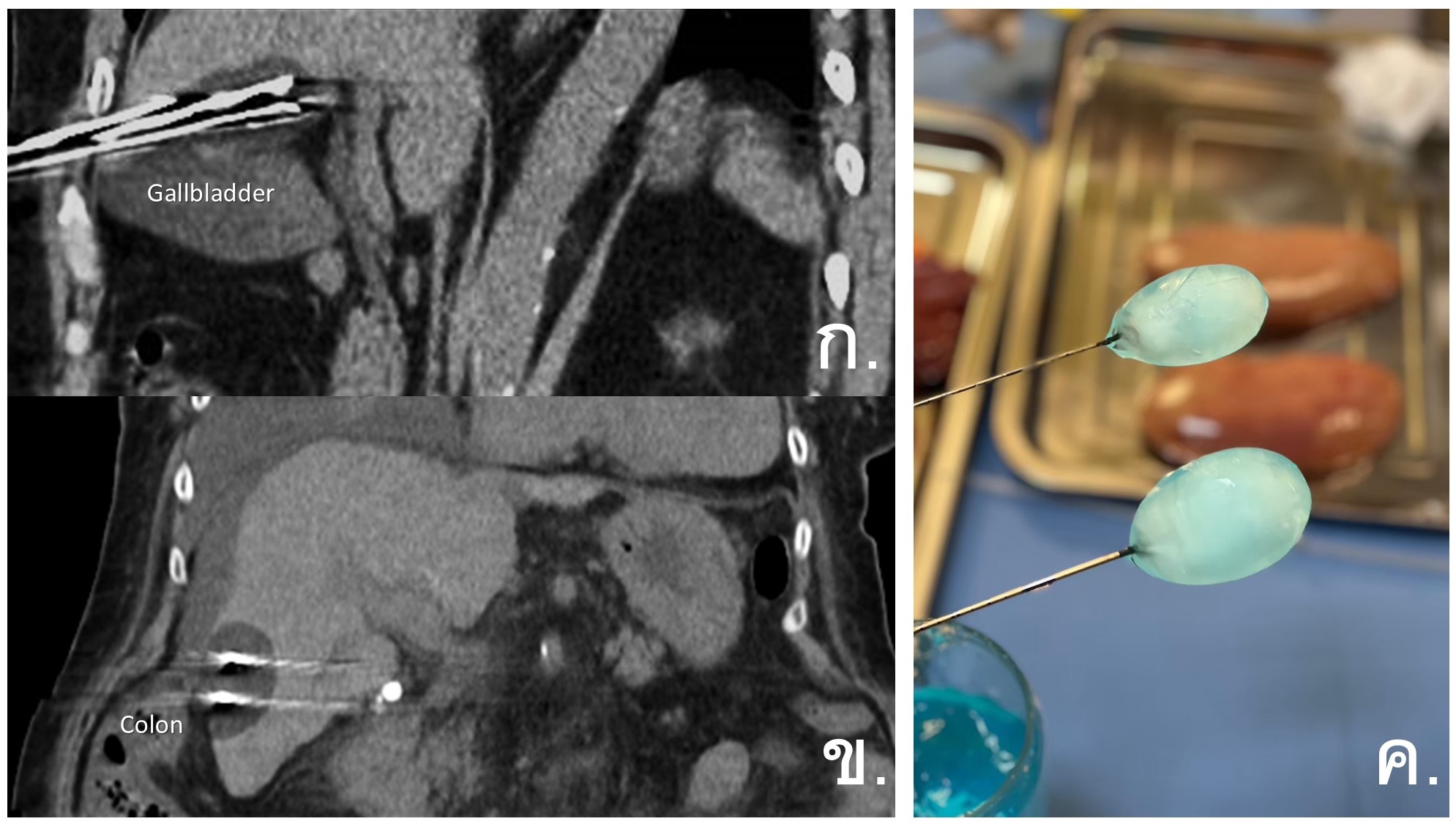
รูปที่ 3- Percutaneous Cryoablation. ก. และข. ภาพ non-contrast CT ขณะทำการรักษามะเร็งตับในตำแหน่งใกล้ถุงน้ำดี (ก.) และใกล้ hepatic flexor colon (ข.) ด้วย Cryoablation ซึ่งจะเห็นขอบเขตของ ice ball เป็น hypoattenuation area, ค. ภาพแสดงการเกิด ice ball formation บริเวณรอบปลายเข็ม
การจี้ก้อนเนื้องอกด้วยกระแสไฟฟ้าความต่างศักย์สูง หรือ Irreversible Electroporation (IRE)
การทำลายก้อนเนื้องอกเฉพาะที่ด้วยกระแสไฟฟ้าความต่างศักย์สูง หรือเรียกอีกชื่อว่า “มีดนาโน (Nanoknife®)” โดยการใช้เข็มขนาดเล็ก (18G) อย่างน้อย 2 เข็ม แต่ไม่เกิน 6 เข็มแทงเข้าไปบริเวณรอบก้อนมะเร็ง และทำให้เกิดกระแสไฟฟ้าความต่างศักย์สูงถึง 3,000 โวลต์ไหลผ่านเซลล์เนื้องอกระหว่างเข็มแต่ละคู่ ส่งผลให้เยื่อหุ้มเซลล์เกิดรูขนาดเล็กจำนวนมากจนทำให้เซลล์ตายแบบถาวร
ข้อเด่นในการรักษาด้วย IRE คือ เป็น non-thermal ablation จึงไม่ทำลายโครงสร้างที่สำคัญของเนื้อเยื่อข้างเคียง รวมถึง collagen ผนังหลอดเลือด และผนังท่อน้ำดี แต่ก็มีข้อจำกัดหลายประการ เช่น มีราคาสูงกว่า มีความยุ่งยากมากกว่าเนื่องจากต้องแทงเข็มหลายตำแหน่ง ผู้ป่วยต้องได้รับการดมยาแบบระงับความรู้สึกทั่วร่างกาย (general anesthesia) ร่วมกับยาคลายกล้ามเนื้อขณะทำหัตถการ และไม่เหมาะกับก้อนเนื้องอกที่อยู่ใกล้หัวใจ หรือผู้ป่วยที่มีโรคประจำตัวเป็นโรคหัวใจ หรือภาวะการเต้นของหัวใจผิดจังหวะ เนื่องจากกระแสไฟฟ้าจะไปรบกวนการเต้นของหัวใจได้
ด้วยคุณลักษณะเฉพาะดังกล่าว IRE สามารถพิจารณาเป็นทางเลือกในการรักษามะเร็งตับ HCC ขนาดเล็ก (≤ 3 เซนติเมตร) ที่ไม่สามารถรักษาได้ด้วยการผ่าตัด และการจี้ทำลายเนื้องอกด้วยเข็มความร้อน เช่น อยู่ใกล้ major bile duct (รูปที่ 4.) หลอดเลือดขนาดใหญ่ หรือ อวัยวะข้างเคียง(12, 13)
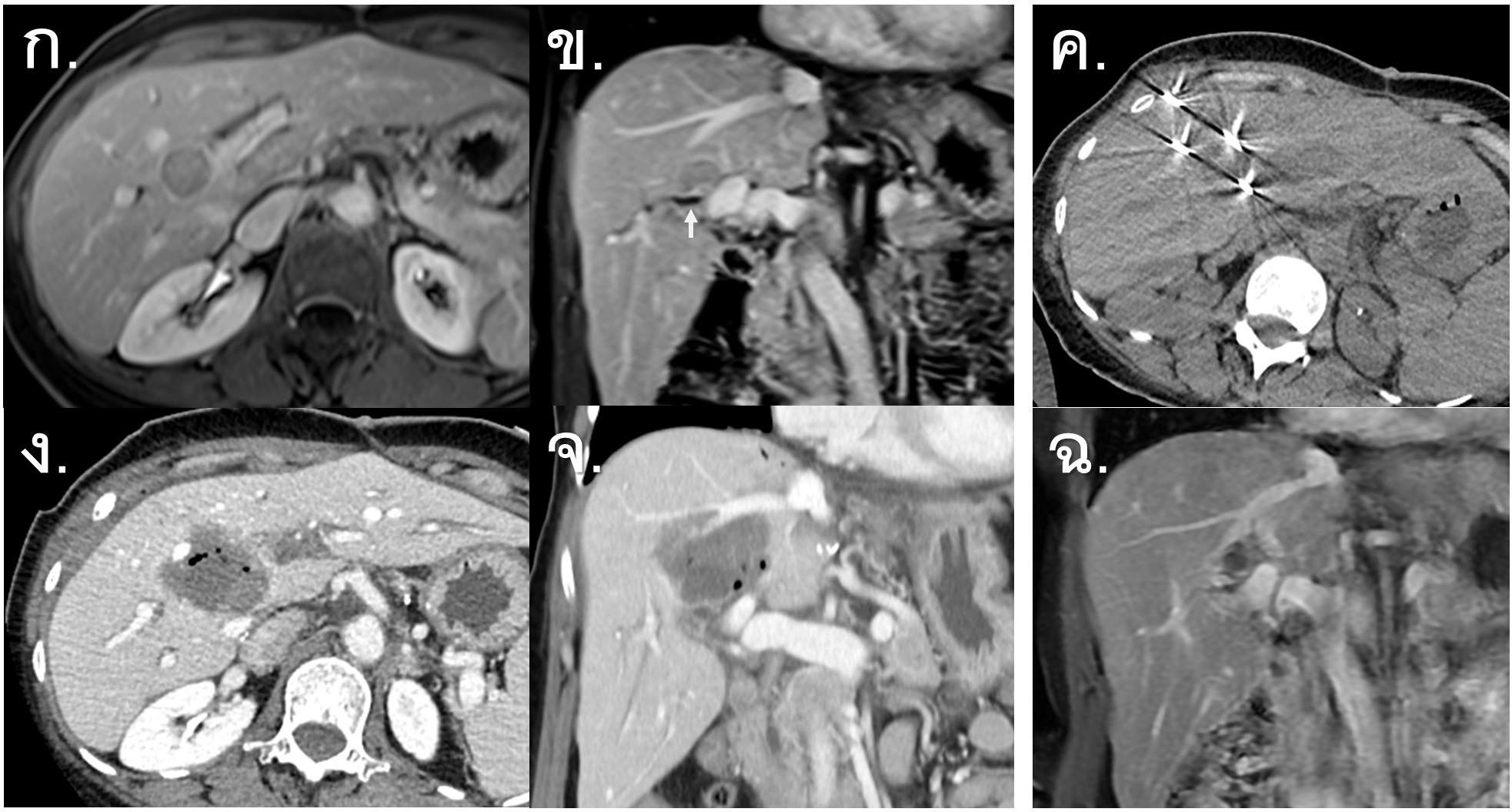
รูปที่ 4- Percutaneous Ablation with Irreversible Electroporation (IRE). ก.และข. ภาพ MRI venous-phase axial view (ก.) และ coronal view (ข.) พบก้อนมะเร็งตับขนาด 2.1 เซนติเมตรที่ perihilar, peribiliary region of right hepatic lobe (arrow = right intrahepatic bile duct), ค. ภาพ non-contrast CT แสดงการรักษาด้วย Percutaneous IRE 4 เข็มแทงโดยรอบบริเวณก้อน, ง. และ จ. ภาพ CT venous-phase หลังการรักษาทันที axial view (ง.) และ coronal view (จ.) แสดงให้เห็นถึงก้อนมะเร็งและเนื้อเยื่อโดยรอบที่ถูกทำลายเป็น non-enhancing area, ฉ. ภาพ MRI venous-phase หลังการรักษา 6 เดือน พบว่า ablation zone มีขนาดเล็กลง ไม่มี recurrence tumor และไม่มี biliary injury
การรักษามะเร็งผ่านทางหลอดเลือดแดงของตับ (Transarterial Treatment)
Lipiodol-TACE หรือ Conventional Transarterial Chemoembolization (C-TACE)
Lipiodol-TACE หรือ C-TACE หรือเรียกสั้นๆว่า TACE เป็น locoregional treatment ที่ใช้บ่อยมากที่สุดในการรักษามะเร็งตับ HCC ซึ่งทำโดยการให้ยาเคมีบำบัดและอุดกั้นหลอดเลือดที่ไปเลี้ยงก้อนมะเร็ง (tumor feeding artery) โดยตรง เนื่องจากมะเร็งตับ HCC เป็นมะเร็งที่มีหลอดเลือดแดงมาเลี้ยงมาก (hypervascular tumor) จึงได้รับเลือดส่วนใหญ่มาจากแขนงของหลอดเลือดแดงตับ (hepatic artery) การให้ยาเคมีบำบัดโดยผสมกับสาร Lipiodol ฉีดผ่านทางสายสวนเข้าไปทางหลอดเลือดที่ไปเลี้ยงก้อนมะเร็งโดยตรง (รูปที่ 5. และ รูปที่ 6.) จะทำให้ก้อนมะเร็งได้รับยาเคมีบำบัดปริมาณสูง ลดผลข้างเคียงของยาเคมีบำบัดต่ออวัยวะอื่นๆ ร่วมกับการอุดหลอดเลือดแดงทำให้ก้อนขาดเลือดไปเลี้ยงและยาเคมีบำบัดค้างอยู่ในก้อนมะเร็งนานขึ้น โดยทั่วไปเนื้อตับปกติจะได้รับผลกระทบจาก TACE น้อยกว่าก้อนมะเร็ง เนื่องจากเนื้อตับปกติได้รับเลือดส่วนใหญ่มาจาก portal vein ดังนั้นการรักษาด้วย TACE จึงไม่เหมาะสมและทำให้การทำงานของตับแย่ลงได้ในกรณีที่ผู้ป่วยมี significant portal vein occlusion จาก portal vein tumor thrombus หรือ portal vein thrombosis
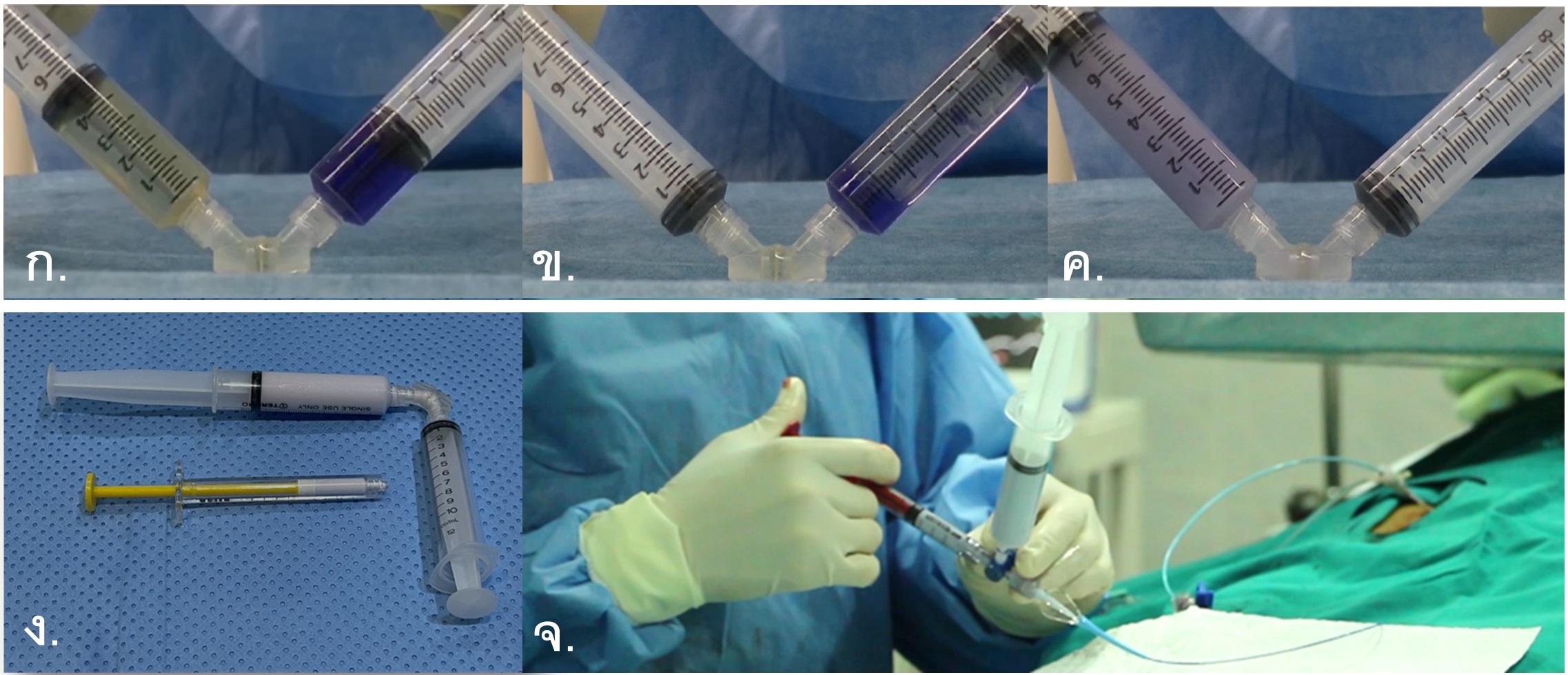
รูปที่ 5- Conventional Transarterial Chemoembolization (C-TACE). ก.-ค. การผสมยาเคมีบำบัดกับสาร Lipiodol, ง. Lipiodol-cytotoxic drug emulsion หลังจากผสมเสร็จ, จ. การฉีด emulsion ผ่านทาง microcatheter ซึ่งปลายสายด้านในตัวผู้ป่วยอยู่ใน hepatic artery ที่ไปเลี้ยงก้อนมะเร็งโดยตรง
รูปที่ 6- Super-selective TACE. ก. ภาพ MRI arterial-phase พบว่ามีก้อนมะเร็งตับขนาด 5.8 เซนติเมตรที่ posterior segment of right hepatic lobe, ข. Right hepatic angiography พบ hypervascular tumor, ค. ภาพแสดงตำแหน่งปลายสาย microcatheter (arrow) ใน tumor arterial feeder ใกล้กับก้อนมะเร็งเพื่อทำ super-selective TACE, ง. ภาพแสดง Lipiodol emulsion จับในก้อนมะเร็งเห็นเป็น hyperdensity หลังการรักษา รวมทั้งมี Lipiodol emulsion opacification ในแขนงของ portal vein รอบๆก้อน (blue arrow head), จ. Right hepatic angiography หลังการทำ TACE พบว่า tumor vascularity หายไป และ non-tumoral parenchymal branch ส่วนใหญ่ยังมีเลือดไปเลี้ยงตามปกติ, ฉ. ภาพ non-contrast CT หลังการรักษาทันที พบว่ามี Lipiodol emulsion (hyperdensity) จับเต็มทั่วทั้งก้อน รวมทั้ง liver parenchyma ข้างเคียง ซึ่ง Lipiodol density บริเวณ liver parenchyma มักจะเลือนหายภายใน 1 สัปดาห์โดยถูก Kupffer cell กำจัด
ข้อมูลจากการศึกษาระยะหลังพบว่าผู้ป่วยที่ได้รับการรักษาด้วย TACE มีอายุขัยเฉลี่ยยืนยาวกว่าในอดีต เช่น การศึกษาแบบ prospective ของ asian population ในปี 2011 และ 2013 ของการรักษาด้วย TACE ใน unresectable HCC พบว่ามีอัตรารอดชีวิต 2.74 ปี(14) และ 3.1 ปี(15) ตามลำดับ ปัจจัยที่สำคัญคือการคัดเลือกกลุ่มผู้ป่วยที่เหมาะสม และการรักษาด้วยเทคนิค super-selective TACE(16-20) ซึ่งประกอบด้วยการวางแผนการรักษาด้วยภาพเอกซเรย์หลอดเลือดแบบ 3 มิติ (3D reconstruction) (รูปที่ 7.) โดยการทำ catheter-directed CTA ด้วยเครื่อง Cone-Beam Computed Tomography (CBCT Angiography) หรือ Multi-Detector Computed Tomography (MDCT) Angiography(19, 20) ช่วยให้รักษาได้อย่างแม่นยำและมีประสิทธิภาพมากกว่าภาพเอกซเรย์หลอดเลือดแบบธรรมดา(21) ร่วมกับการใส่สายสวนหลอดเลือดขนาดเล็ก (microcatheter) เข้าไปยัง tumor feeding artery ให้ใกล้กับก้อนมะเร็งมากที่สุด (super-selective catheterization) เพื่อเพิ่มประสิทธิภาพการรักษาและลดผลข้างเคียงต่อเนื้อตับ ยาเคมีบำบัดที่ใช้บ่อยในการทำ TACE ได้แก่ Doxorubicin, Mitomycin-C, 5-FU หรือ Cisplatin อาจจะใช้แบบ single agent หรือ combination โดยปริมาณยาเคมีบำบัดและ Lipiodol ที่ใช้จะแปรตามขนาดของก้อน
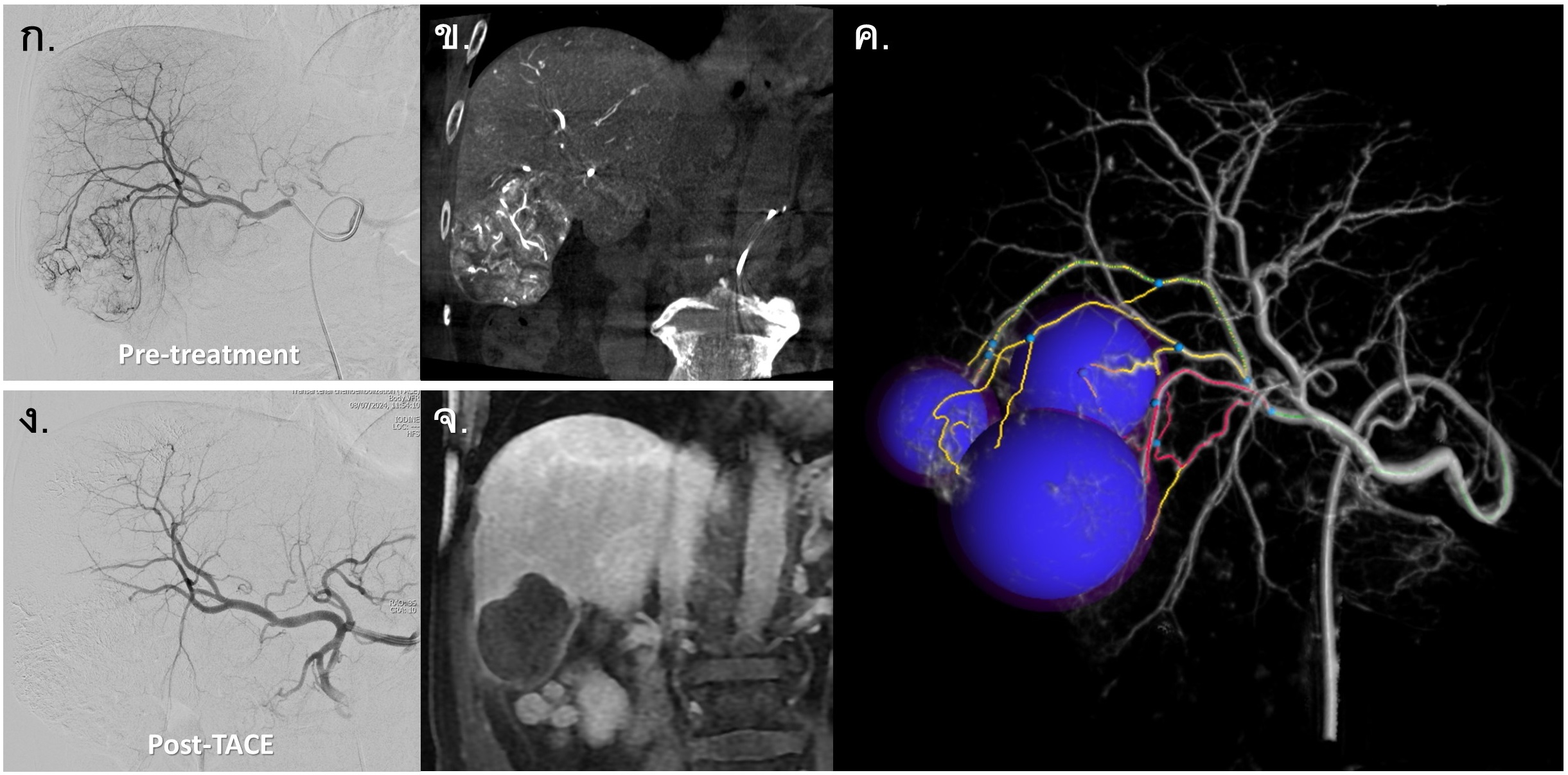
รูปที่ 7- การวางแผนการทำ Super-selective TACE ด้วยเทคนิค Cone-Beam Computed Tomography (CBCT Angiography). เปรียบเทียบภาพ Hepatic angiography (ก.), Coronal image of catheter-directed CT angiography (ข.) และ 3D reconstruction with embolization planning (ค.) ในผู้ป่วยมะเร็งตับ โดยภาพ catheter-directed CT angiography (ข.) จะช่วยบอกขนาด ขอบเขต และจำนวนของ hypervascular tumor ได้ชัดเจนเนื่องจากฉีดสารทึบรังสีผ่านทาง hepatic artery โดยตรง และเมื่อนำข้อมูลมาประมวลผลเป็นภาพภาพ 3 มิติทำให้กำหนด targeted arterial feeders ที่ไปเลี้ยงก้อนมะเร็งได้อย่างแม่นยำ นอกจากนี้ยังช่วยจำแนกแขนงของหลอดเลือดที่ทับซ้อนกันในภาพ 2 มิติได้ดีโดยอาศัยมุมที่ต่างกันออก และใช้ภาพ 3D reconstruction ดังกล่าวเพื่อทำงานร่วมกับเครื่องเอกซเรย์หลอดเลือดในการทำ super-selective TACE, ง. Hepatic angiography หลังการทำ TACE พบว่า tumor vascularity หายไป และ non-tumoral parenchymal branch ส่วนใหญ่ยังมีเลือดไปเลี้ยงตามปกติ, จ. MRI with contrast หลังจากการักษา 6 สัปดาห์ พบว่ามี complete tumor necrosis
นอกจากนี้มะเร็งตับ HCC ยังพบว่าอาจมีหลอดเลือดแดงนอกตับ (extrahepatic collateral arteries)(22, 23) มาเลี้ยงก้อนจากหลอดเลือดแดงหลายแขนงทั้งจากช่องท้องและช่องอก โดยเฉพาะก้อนมะเร็งขนาดใหญ่ หรืออยู่ชิดผิวตับ หรือเคยผ่านการรักษาด้วย TACE มาก่อน Extrahepatic collateral arteries ที่พบบ่อย ได้แก่ right inferior phrenic artery (รูปที่ 8.), right gastroepiploic artery, right intercostal artery และ right adrenal artery เป็นต้น แพทย์สามารถทำการรักษาด้วย TACE ผ่านทางหลอดเลือดเหล่านี้จะช่วยเพิ่มประสิทธิภาพของการทำ TACE(22, 23) และต้อง selective catheterization ด้วยความระมัดระวังเพื่อป้องกัน non-target embolization แต่หากปล่อยทิ้งไว้ไม่ได้รักษาก็จะยังมี tumor feeding artery เข้าไปเลี้ยงก้อนมะเร็ง เป็น residual disease หรือ progressive disease ได้
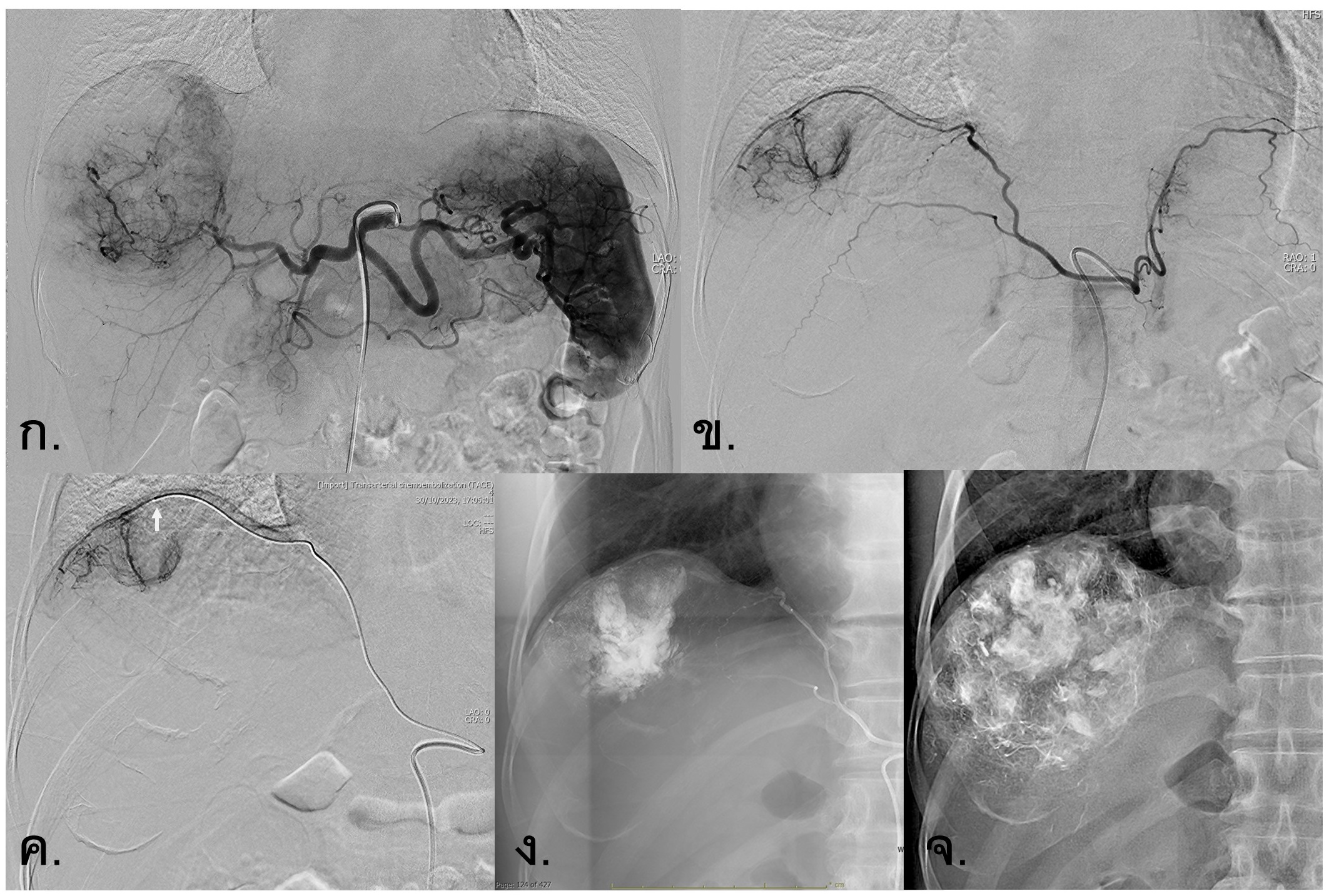
รูปที่ 8- Extrahepatic collateral supply from right inferior phrenic artery (RIPA). ก. Celiac angiography พบ large hypervascular tumor บริเวณ superior segment of right hepatic lobe ซึ่งมี enhancement defect ที่บริเวณด้านบนของก้อน, ข. Angiography of bilateral phrenic arteries พบว่ามี abnormal neoplastic enhancement จาก right inferior phrenic artery (RIPA) ที่ไปเลี้ยงด้านบนของก้อน, ค. Super-selective angiography ไปยังแขนงของ RIPA โดยปลายสาย microcatheter (arrow) อยู่ใน tumor arterial feeder เพื่อทำ super-selective TACE, ง. ภาพแสดง Lipiodol emulsion จับบริเวณด้านบนของก้อนหลังการรักษาด้วย TACE ผ่านทางแขนงของ RIPA, จ. ภาพแสดง Lipiodol emulsion จับในก้อนส่วนที่เหลือหลังการรักษาด้วย TACE เพิ่มเติมผ่านทางแขนงของ right hepatic artery
หลังการรักษาก็จะนำสายสวนออก และนัดตรวจติดตามผลการรักษาด้วย CT scan หรือ MRI เพื่อดูขนาดและจำนวนก้อน ร่วมกับผลเลือดค่าการทำงานของตับและค่า tumor marker ในกรณีที่ผู้ป่วยที่มีก้อนมีขนาดใหญ่หรือมีก้อนหลายตำแหน่งและยังให้การรักษาไม่ครบในครั้งเดียว สามารถรักษาโดยวิธี TACE ซ้ำได้โดยเว้นระยะห่างอย่างน้อย 4-6 สัปดาห์ โดยการพิจารณาการรักษาซ้ำด้วย TACE แบบ on demand(20) โดยพิจารณาถึง การตอบสนองต่อการรักษา ผลข้างเคียงจากการรักษา และการทำงานของตับร่วมด้วย เนื่องจากการรักษาด้วย TACE มักจะส่งผลกระทบต่อการทำงานของตับได้(24) โดยเฉพาะในกรณีทีมีก้อนหลายตำแหน่ง ก้อนขนาดใหญ่ หรือผู้ป่วยตับแข็งที่มีการทำงานของตับบกพร่อง จึงควรประเมินการทำงานของตับและ tumor burden ทุกครั้งก่อนพิจารณาการรักษาซ้ำด้วย TACE
ผลข้างเคียงหลังการรักษาด้วย TACE(25) ที่พบบ่อยมาก ได้แก่ post embolization syndrome ประกอบด้วยอาการไข้ต่ำๆ ปวดท้อง คลื่นไส้ อาเจียน เกิดอาการในช่วง 1-3 วันหลังการรักษาหรืออาจจะนานกว่านั้น อาการมักจะหายได้เอง พบได้บ่อยและมีอาการมากกว่าในผู้ป่วยที่มีก้อนขนาดใหญ่ สำหรับภาวะแทรกซ้อนรุนแรงอื่นๆที่อาจเกิดขึ้น ได้แก่ hepatic insufficiency or infarction, liver abscess, cholecystitis, gastrointestinal bleeding, biliary necrosis, bile duct stricture, liver failure และ non-target embolization เป็นต้น และ TACE มี 30-day mortality ประมาณร้อยละ 1
TACE เป็นการรักษาหลักในผู้ป่วยระยะ intermediate stage (BCLC stage B) โดยลักษณะก้อนมะเร็งที่เหมาะสมคือ ก้อนมะเร็งที่มีขอบเขตชัดเจน (nodular type) ขนาดและจำนวนก้อนไม่มากจนเกินไป, preserved portal flow และสามารถใส่สายสวน (selective access) เข้าไปยัง feeding tumor arteries ได้(1) นอกจากนี้ยังอาจใช้ในผู้ป่วยมะเร็งตับระยะแรก (early stage)(26) ซึ่งไม่สามารถรักษาด้วยการผ่าตัดหรือ tumor ablation หรือผู้ป่วยมะเร็งตับ advanced stage ที่มี portal vein invasion เพียงบางส่วน (segmental or subsegmental portal vein invasion)(20, 27, 28), liver-only หรือ liver-dominant disease(20) สามารถเพิ่มอัตรารอดชีวิตได้ในผู้ป่วยที่มีสภาพการร่างกายรวมถึงทำงานของตับอยู่ในเกณฑ์ดี
ข้อบ่งชี้ในการทำ TACE
- มะเร็งตับที่ไม่สามารถผ่าตัดได้ (unresectable HCC)
- เพื่อลดขนาดของก้อนมะเร็งตับก่อนการผ่าตัด (preoperative neoadjuvant or downstaging/ downsizing)
- เพื่อลดขนาดและจำนวนก้อนมะเร็ง (down-staging) หรือ ควบคุมการเจริญเติบโตของก้อนมะเร็งตับระหว่างรอการผ่าตัดปลูกถ่ายตับ (bridging to transplantation)
- เพื่อรักษาแบบประคับประคองตามอาการ ในกรณีที่มีอาการปวด หรือก้อนมะเร็งตับแตกทำให้มี เลือดออกในช่องท้อง (ruptured HCC) ซึ่งมักจะทำการรักษาด้วยการอุด tumor feeding arteries ด้วย gelatin sponge หรือ embolic particles โดยไม่ให้ยาเคมีบำบัดร่วมด้วย เรียกว่า Transarterial Embolization
Absolute Contraindication ของการทำ TACE(25, 29)
- ผู้ป่วยมีสมรรถภาพการทำงานของตับประเมินด้วย Child-Pugh score ≥9
- มะเร็งตับมีการลุกลามเข้าสู่ superior mesenteric vein หรือ inferior vena cava
- มะเร็งตับที่ลุกลามเข้าสู่และอุดตัน main portal vein และ/หรือ bilateral portal veins
- มีภาวะการติดเชื้อรุนแรง (intractable infection)
- มีประวัติแพ้สารทึบรังสีอย่างรุนแรง (severe contrast allergy) หรือ ข้อห้ามอื่นๆในการทำ angiogram
Relative Contraindication ของการทำ TACE(25, 29)
- มะเร็งกระจายนอกตับหลายตำแหน่ง (extensive extrahepatic disease)
- Serum bilirubin ≥3 mg/dL
- Significant arteriovenous shunting
- Tumor burden >50% ของ total liver volume
- ผู้ป่วยที่มีสภาพร่างกายไม่แข็งแรง ECOG performance status 3 หรือ 4
- ภาวะไตวายระยะสุดท้าย (severe renal insufficiency) ที่ไม่ได้ฟอกเลือดล้างไต
- มีประวัติการผ่าตัดต่อท่อน้ำดีกับลำไส้ (biliary-enteric anastomosis)
- มีการอุดตันของทางเดินน้ำดี (biliary obstruction)
- มีภาวะเลือดออกจากทางเดินอาหารเมื่อไม่นานมานี้ (recent GI bleeding)
- ภาวะเลือดแข็งตัวผิดปกติที่ไม่สามารถแก้ไขได้ (uncorrectable coagulopathy)
- ภาวะท้องมาน (ascites) ที่ไม่สามารถควบคุมด้วยยาขับปัสสาวะ
การรักษาด้วย TACE ผ่านทาง Radial artery (Transradial TACE)(30)
ในปัจจุบันสามารถเลือกพิจารณาการรักษาด้วย TACE ผ่านทาง left radial artery หรือ เรียกว่า Transradial TACE โดยแทง artery access เข้าทาง left radial artery ที่บริเวณข้อมือหรือโคนนิ้วหัวแม่มือ (anatomical snuffbox) (รูปที่ 9.) ในกรณีที่ผู้ป่วยมีข้อห้ามหรือข้อจำกัดในการรักษาทาง femoral artery access เช่น thrombocytopenia, uncorrectable coagulopathy หรือ ผู้ป่วยที่ไม่สามารถหยุด antiplatelet/ anticoagulant drugs ผู้ป่วยที่มี aortoiliac occlusion หรือ femoral occlusion โดยผู้ป่วยจะต้องได้รับการตรวจประเมิน radial artery diameter ร่วมกับ ulnar artery patency ด้วย Barbeau Test (Modified Allen’s test) เพื่อวางแผนการรักษา ซึ่งการทำ Transradial TACE ช่วยลดโอกาสเกิดภาวะแทรกซ้อนโดยเฉพาะ ภาวะเลือดออกบริเวณ puncture site และผู้ป่วยสามารถ early ambulation ได้ทันทีหลังทำหัตถการ
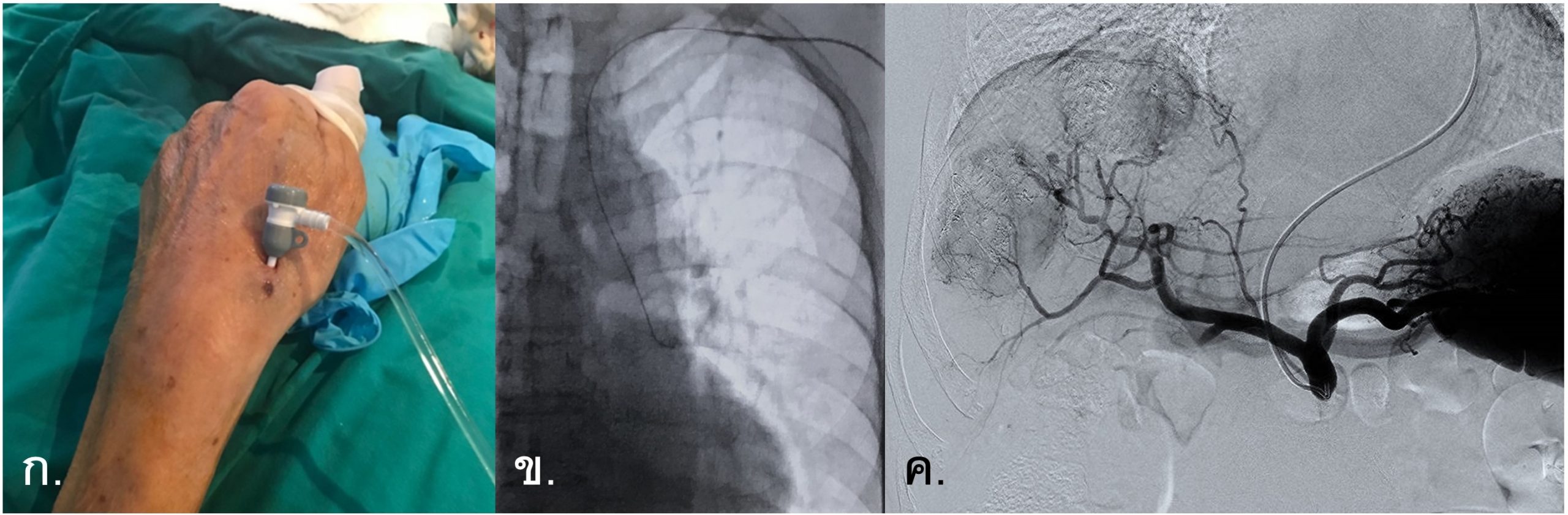
รูปที่ 9- Transradial TACE. ก. ภาพแสดง artery access เข้าทาง left distal radial artery ที่บริเวณโคนนิ้วหัวแม่มือ (anatomical snuffbox), ข. ภาพ fluoroscopy การนำ guide wire และ catheter จาก left radial artery มายัง left subclavian artery และเข้าสู่ descending thoracic aorta, ค. Celiac angiography จาก transradial access เพื่อทำ TACE พบมี two hypervascular masses ใน right hepatic lobe
ผู้ป่วยมะเร็งตับที่ไม่ตอบสนองต่อการรักษาด้วย TACE (TACE refractoriness)(31) หมายถึง ผู้ป่วยที่ได้รับการทำ TACE อย่างน้อย 2 ครั้งติดกันใน 8 สัปดาห์ และมีลักษณะการดำเนินโรคดังต่อไปนี้
- ก้อนมะเร็งตายน้อยกว่าร้อยละ 50 และ/หรือ มีก้อนมะเร็งเกิดขึ้นใหม่หลายก้อน หลังจากได้รักษาโดย TACE ทาง feeding arteries อย่างถูกต้องเหมาะสมแล้ว หรือได้ลองเปลี่ยน chemotherapeutic agents แล้ว
- ระดับ AFP เพิ่มขึ้นอย่างต่อเนื่องหลังการรักษาด้วย TACE
- พบมี vascular invasion
- พบมีการแพร่กระจายของมะเร็งออกนอกตับ
หากผู้ป่วยเข้าเกณฑ์ TACE refractoriness ข้างต้น การทำ TACE เพิ่มเติมไม่ได้ประโยชน์ในการเพิ่มอัตราการรอดชีวิต นอกจากนี้หากหลังการรักษาด้วย TACE แล้วผู้ป่วยมีสภาพการทำงานของตับทรุดลงอย่างชัดเจน (Child Pugh score เพิ่มขึ้นอย่างน้อย 2 คะแนน)(29) หรือสภาพร่างกายทรุดลง มี ECOG performance status เปลี่ยนแปลง ในกรณีเหล่านี้ควรพิจารณาหยุดการรักษาโดย TACE และพิจารณาทางเลือกอื่นในการรักษาด้วย systemic treatment แทน
ในกรณีที่ผู้ป่วยไม่ตอบสนองหลังการรักษาด้วย Lipiodol TACE และยังมีการทำงานของตับอยู่ในเกณฑ์ดี สามารถพิจารณาทางเลือกในการรักษาด้วย Drug-Eluting Bead Transarterial Chemoembolization (DEB-TACE)(27) หรือ Y-90 Transarterial Radioembolization (TARE)(27, 29) ได้
การรักษามะเร็งตับ HCC ด้วยการทำ TACE และ Portal Vein Embolization (PVE) ก่อนการผ่าตัด
Portal vein embolization (PVE) เป็นการรักษาแบบ minimally invasive โดยแทงเข็มผ่านทางผิวหนังและเนื้อตับเข้าไปยัง portal vein โดยตรง และใส่วัสดุอุดกั้นหลอดเลือดผ่านทางสายสวนเข้าไปใน portal vein ของตับข้างที่ต้องการจะตัดออก ทำให้ตับข้างดังกล่าวขาดเลือดไปเลี้ยงจนมีขนาดเล็กลง ส่วนเนื้อตับด้านตรงข้าม (future liver remnant, FLR) จะมีปริมาตรเพิ่มขึ้นก่อนการผ่าตัด การทำ PVE จึงสามารถช่วยให้ผู้ป่วย HCC ที่มีปริมาตรตับไม่เพียงพอ (inadequate FLR) สามารถเข้ารับการผ่าตัดได้มากขึ้น(27)
ผู้ป่วยมะเร็งตับ HCC จำเป็นต้องได้รับการรักษาก้อนมะเร็งด้วย TACE เพื่อควบคุมก้อนมะเร็งก่อน เนื่องจากการอุด portal vein จะทำให้ hepatic artery มีขนาดใหญ่ขึ้นเพื่อนำเลือดมาเลี้ยงตับทดแทน จึงอาจทำให้ก้อนมะเร็งโตเร็วขึ้นด้วย การทำ sequential TACE and PVE(32) (รูปที่ 10.) ปลอดภัยและช่วยเพิ่มโอกาสการผ่าตัดในผู้ป่วย HCC ได้ โดยทั่วไปจะทำ PVE หลังจาก TACE ประมาณ 2-4 สัปดาห์ และวัดปริมาตรของตับ FLR ซ้ำหลังจากการทำ PVE ประมาณ 3-4 สัปดาห์ (รูปที่ 11.)
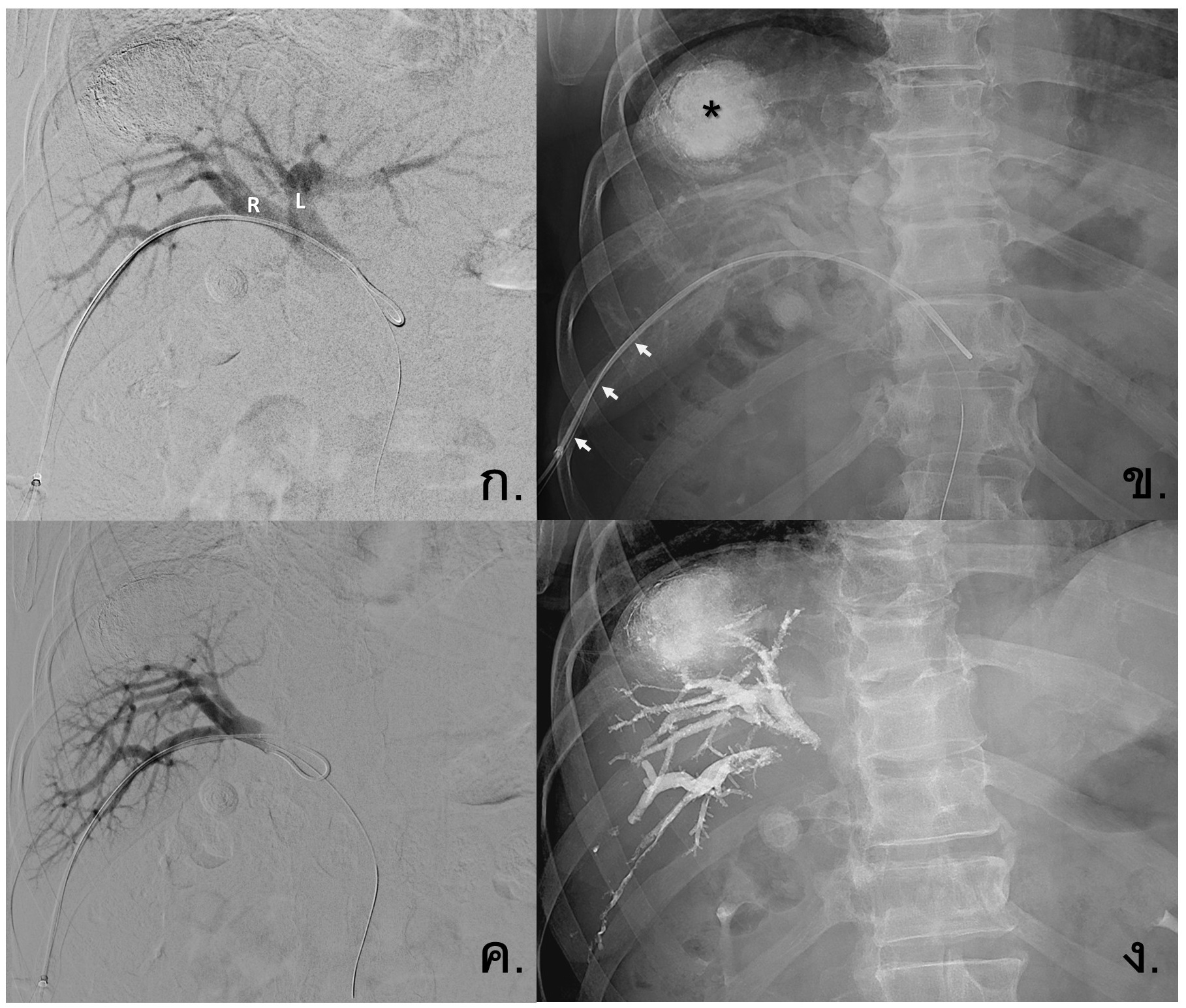
รูปที่ 10- Sequential TACE and right portal vein embolization (PVE). ผู้ป่วย HCC ที่ได้รับการทำ TACE มาก่อน มี Lipiodol-staining tumor mass(*) ที่ superior segment of right hepatic lobe, ก. และข. ภาพ Percutaneous portography โดยใส่สายสวนเข้ามาทาง right portal vein branch (arrow) โดยปลาย catheter อยู่ใน main portal vein จากภาพ ก. จะเห็นแขนงของ right portal vein (R) และ left portal vein (L), ค. Selective portography of right portal vein for embolization, ง. ภาพหลังการรักษา PVE จะเห็น hyperdensity ของ Lipiodol-glue mixture ในแขนงต่างๆของ right portal vein
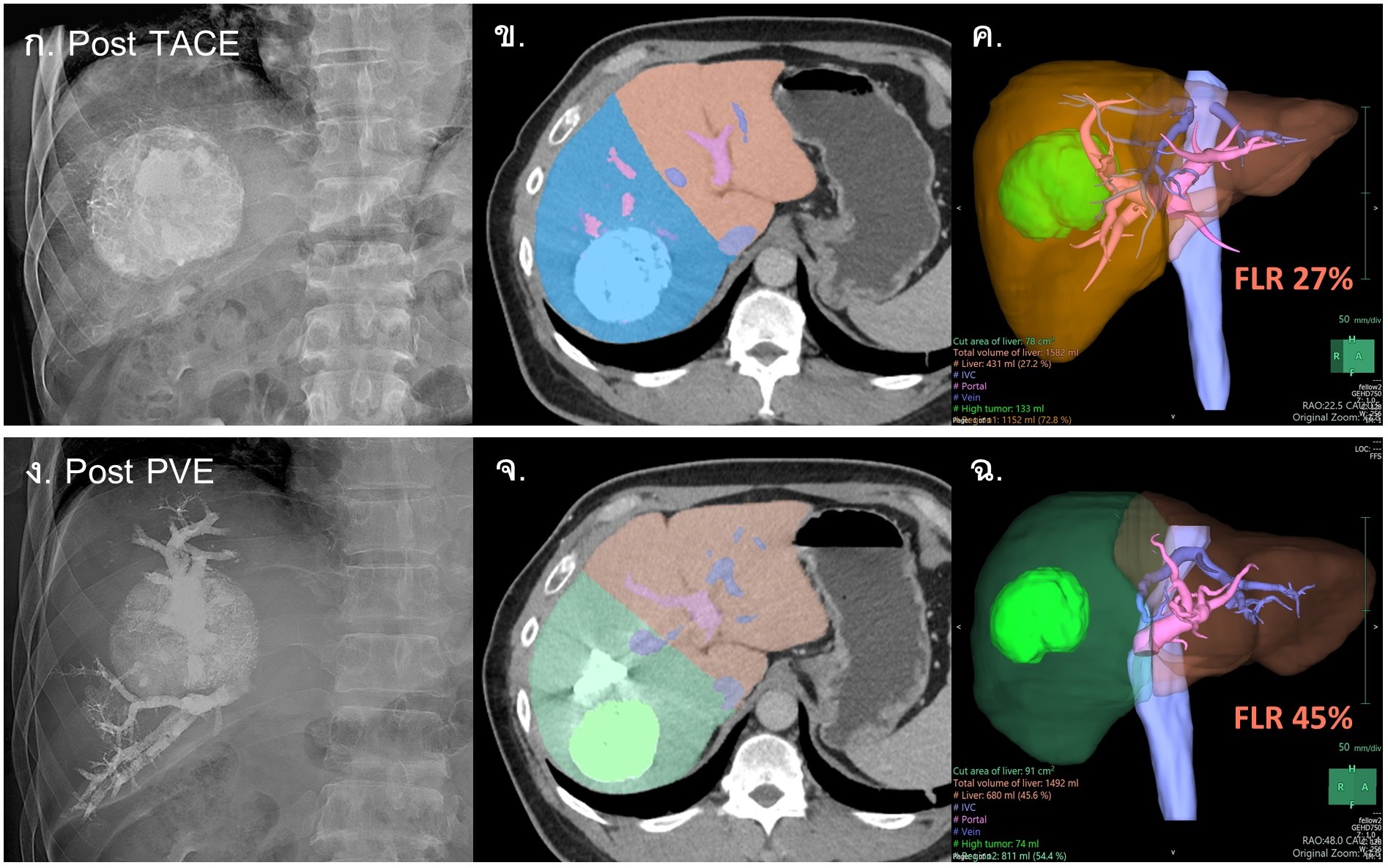
รูปที่ 11- Portal vein embolization (PVE)-induced liver hypertrophy. ภาพเปรียบเทียบ CT volumetry ในผู้ป่วย HCC ก่อน PVE (ภาพ ก., ข. และ ค.) และหลัง PVE 4 สัปดาห์ (ภาพ ง., จ. และ ฉ.) โดยหลังการรักษาด้วย PVE ผู้ป่วยมี left lobe hypertrophy และ right lobe atrophy เมื่อคำนวณ future liver remnant (FLR) เพิ่มขึ้นจากร้อยละ 27 เป็น ร้อยละ 45 ซึ่งคำนวณจาก left lobe volume หารด้วย total liver parenchymal volume
หัตถการ PVE มี technical success rate สูงมากกว่าร้อยละ 95(33) แต่อย่างไรก็ตามโอกาสที่ผู้ป่วยจะได้รับการผ่าตัดขึ้นกับหลายปัจจัย ทั้ง intrahepatic disease, extrahepatic metastasis, FLR hypertrophy rate และ general medical condition
Drug-Eluting Bead Transarterial Chemoembolization (DEB-TACE)
DEB-TACE เป็นการรักษามะเร็งตับด้วยยาเคมีบำบัดร่วมกับการอุดกั้นหลอดเลือดแดงผ่านทางสายสวนขนาดเล็ก และมีขั้นตอนการรักษาคล้ายกับการทำ conventional TACE เพียงแต่มีข้อแตกต่างคือการใช้ bead (Drug-Eluting Bead, DEB) (รูปที่ 12.) ซึ่งเป็นอนุภาคขนาดเล็กผสมกับยาเคมีบำบัดแทน Lipiodol โดยมีขนาด bead เมื่อผสมกับยาแล้วให้เลือกใช้ตั้งแต่ 70-1000 ไมครอน และยาเคมีบำบัดที่ใช้แพร่หลายที่สุดในการรักษาด้วย DEB-TACE ใน HCC คือ Doxorubicin
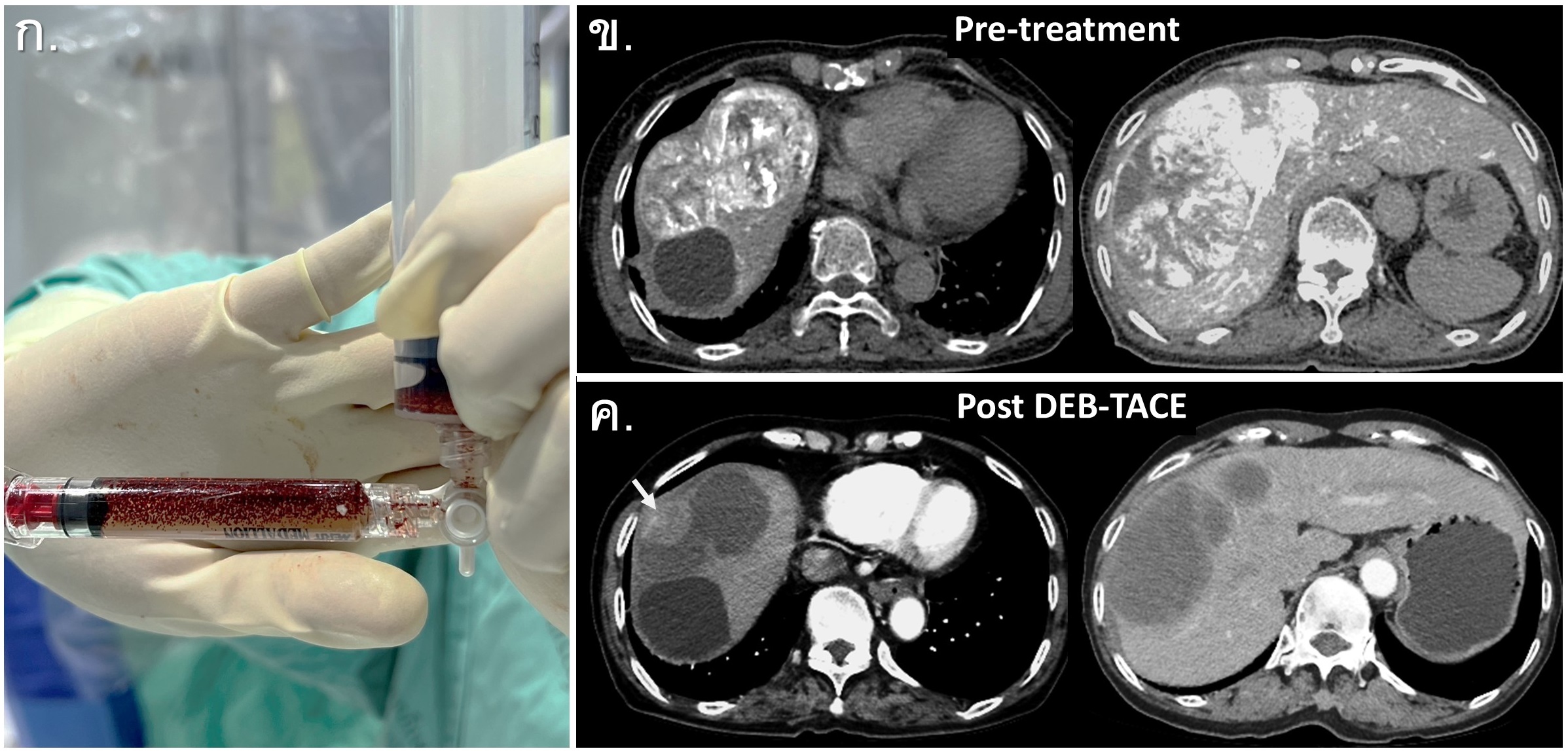
รูปที่ 12- Drug-Eluting Bead Transarterial Chemoembolization (DEB-TACE). ก. ภาพ Doxorubicin-loaded microspheres เพื่อใช้ฉีดผ่าน microcatheter ในการทำ DEB-TACE, ข. ภาพ axial image of catheter-directed CTA ในผู้ป่วย multifocal bilobar HCCs ก่อนการรักษาพบว่ามี multiple hypervascular tumors, ค. ภาพ axial image of CT arterial phase ตรวจติดตาม 4 สัปดาห์หลังการรักษาด้วย DEB-TACE 2 ครั้ง (ห่างกัน 6 สัปดาห์) พบว่าก้อนมะเร็งมีขนาดเล็กลง และส่วนใหญ่เปลี่ยนเป็น hypodensity area จาก tumor necrosis โดยตำแหน่งที่ยังมี arterial enhancement (arrow) หมายถึง residual viable tumor
DEB-TACE จะมี pharmacokinetics ของยาเคมีบำบัดดีกว่าเมื่อเทียบกับ Lipiodol-TACE(34) สามารถเพิ่มระยะเวลาในการปล่อยยาเคมีบำบัดไปยังก้อนมะเร็ง ช่วยเพิ่ม intratumor drug concentration และช่วยลด serum drug concentration อย่างไรก็ดี อัตราการรอดชีวิตของผู้ป่วยที่รักษาด้วย Lipiodol-TACE และ DEB-TACE ถือว่าไม่แตกต่างกันอย่างมีนัยสำคัญทางสถิติ(20, 35-37) และมีข้อบ่งชี้ตลอดจนข้อห้ามในการรักษาเช่นเดียวกัน แต่ DEB-TACE อาจช่วยลด serious liver toxicity(36), Doxorubicin-related side effects(36) และ ลด post procedural pain(37) ได้
นอกจากนี้ DEB-TACE ยังสามารถเป็นทางเลือกการรักษาได้ในกรณีที่ไม่ตอบสนองต่อการรักษาด้วย conventional TACE(27)
Y-90 Transarterial Radioembolization (TARE) หรือ Selective Internal Radiation Therapy (SIRT)
Y-90 TARE หรือ SIRT คือการฉีดสารกัมมันตภาพรังสี Yttrium-90 (Y-90) microsphere ผ่านทาง hepatic artery ที่ไปเลี้ยงก้อนมะเร็ง ซึ่งสาร Y-90 จะปล่อยรังสีเบต้าออกมาทำลายเซลล์มะเร็งโดยรอบ มี half-life 2.67 วัน และ tissue penetration เฉลี่ย 2.5 มิลลิเมตร โดยการฉีดผ่านทาง hepatic artery หรือร่วมกับการทำ selective catheterization จะทำให้ก้อนมะเร็ง HCC ที่เป็น hypervascular tumor ได้รับปริมาณรังสีสูงกว่าเนื้อตับปกติหลายเท่า และในขณะเดียวกันเนื่องจาก microspheres มีขนาดเล็กมาก (Sirsphere 20-60 microns และ Therasphere 15-35 microns) จึงไม่ทำให้หลอดเลือดอุดตัน (microembolic effect) จึงปลอดภัยและมีประสิทธิภาพสำหรับใช้ในการรักษาผู้ป่วย HCC with portal vein thrombosis (38) (รูปที่ 13.) ซึ่งจะได้ผลดีในกรณีที่ไม่มีการลุกล้ำเข้า main portal vein, tumor burden ≤50% และ total bilirubin ≤1.2mg/DL(39)
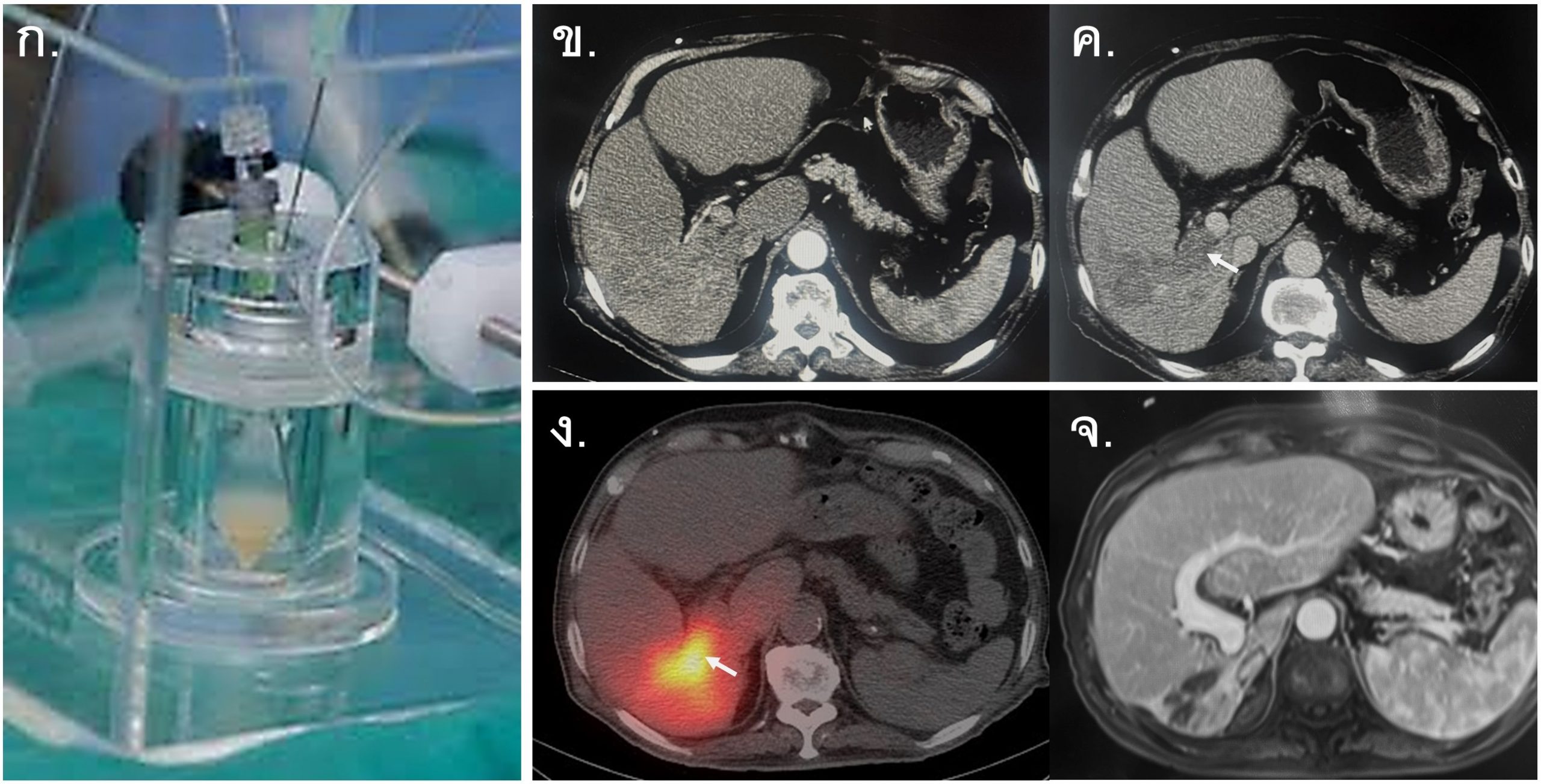
รูปที่ 13- Yttrium-90 Radioembolization in HCC with portal vein thrombosis (PVTT). ก. ภาพ vial บรรจุสาร Y-90 microspheres สำหรับฉีดผ่าน microcatheter ในการทำ Transarterial Radioembolization (TARE), ข. และค. ภาพ axial CT arterial phase (ข.) และ venous phase (ค.) ของผู้ป่วย HCC ก่อนการรักษา พบว่ามี infiltrative hypervascular tumor ใน right hepatic lobe ร่วมกับ enhancing tumor thrombus ใน right portal vein (arrow), ง. ภาพ Bremsstrahlung SPECT-CT 14 ชั่วโมง หลังการรักษาด้วย Y-90 TARE พบว่ามี radioactivity ใน right hepatic lobe โดยเฉพาะบริเวณ tumor and portal vein tumor thrombus (arrow), จ. MRI with contrast หลังการรักษา 12 เดือน พบ non-enhancing tumor thrombus ที่มีขนาดเล็กลง, right lobe atrophy มากขึ้น และมี diffuse heterogenous enhancement จาก post radiation changes
Y-90 TARE ได้รับการรับรองจาก U.S. Food and Drug Administration (FDA) ตั้งแต่ปี ค.ศ.1999 ในการรักษามะเร็งตับ ตามข้อบ่งชี้ คือ unresectable HCC, with or without portal vein thrombosis และ bridge to transplantation(40) เป็นการรักษาที่แนะนำใน BCLC 2022 guideline ในผู้ป่วย Single HCC ≤8 cm(1) ที่ไม่ได้สามารถรักษาด้วยการผ่าตัด, tumor ablation หรือ liver transplant ได้ และ AASLD 2023 guideline(41) ยังแนะนำให้ Radiation segmentectomy (หรือ Selective TARE หรือ Ablative SIRT) เป็นทางเลือกการรักษาในผู้ป่วย BCLC A ที่ไม่สามารถผ่าตัดได้, tumor downstaging และ ผู้ป่วย HCC BCLC B
Radiation segmentectomy(27, 41, 42) (รูปที่ 14.) หรือเรียกอีกอย่างว่า Ablative SIRT(43) คือการรักษาด้วย Y-90 โดยให้ปริมาณรังสีสูงมากไปยังก้อนมะเร็งอยู่ในเนื้อตับ 1-3 segments(43) รวมถึงเนื้อตับบริเวณรอบก้อนถูกทำลายด้วย โดยปริมาณรังสียิ่งสูงมากยิ่งมีโอกาสทำให้เซลล์มะเร็งจนตายทั้งหมดได้ (complete tumor necrosis) ได้สูงขึ้น(44) จึงจัดเป็นการรักษาที่หวังผลหายขาด (curative intent) ซึ่งให้ผลการรักษาเทียบเท่า TACE plus Microwave ablation ในก้อนมะเร็งขนาดไม่เกิน 3 cm(45) และได้ผลดีกว่าการรักษาด้วย selective TACE อย่างมีนัยสำคัญทางสถิติ โดย complete response rate of target lesion ของ 132 tumors จากผู้ป่วย 101 รายสูงถึงร้อยละ 92(46) ทั้งนี้ปริมาณ absorbed dose ที่เหมาะสมสำหรับ curative intent คือ >250Gy สำหรับ resin microsphere หรือ >400Gy สำหรับ glass microsphere(47)
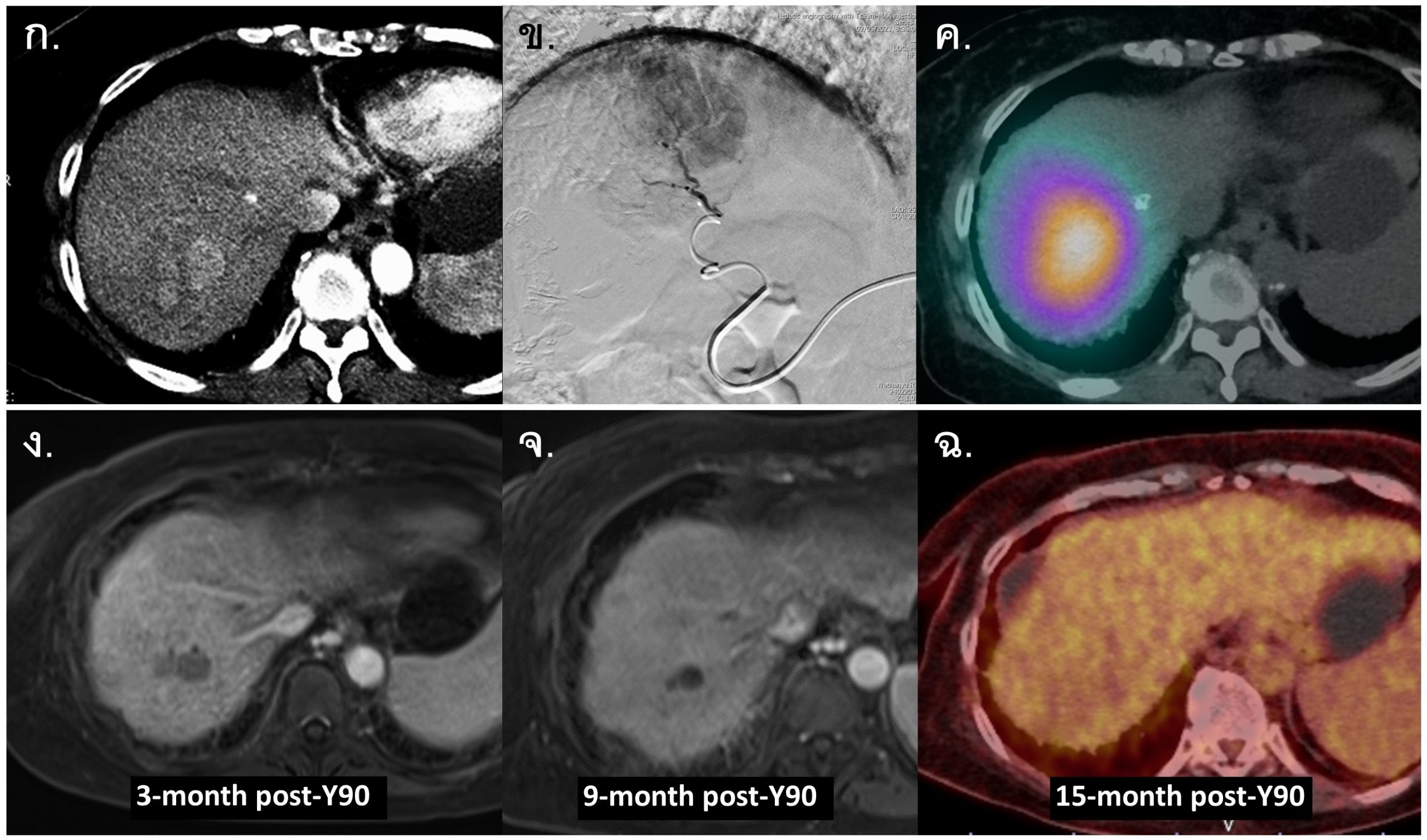
รูปที่ 14- Yttrium-90 Radiation Segmentectomy. ผู้ป่วยหญิงอายุ 85 ปี underlying liver cirrhosis CTP score 6, ก. CT arterial-phase พบ HCC ขนาด 6 เซนติเมตร ใน hepatic segment 7 และ 8, ข. Selective angiography with microcatheter for Y-90 TARE โดยคำนวณ tumor absorbed dose 250 Gy, ค. ภาพ Bremsstrahlung SPECT-CT 14 ชั่วโมง หลังการรักษาด้วย Y-90 TARE พบ dense radioactivity ใน tumor รวมทั้ง hepatic segment 7 และ 8, ง. ภาพ MRI หลังการรักษา 3 เดือน พบว่าก้อนมะเร็งมีขนาดเล็กลงมาก และไม่เห็น internal enhancement ชัดเจน, จ. ภาพ MRI หลังการรักษา 9 เดือน พบว่าก้อนมะเร็งมีขนาดเล็กลง และ complete tumor necrosis, ฉ. ภาพ FDG-PET CT หลังการรักษา 15 เดือน ไม่พบ hypermetabolic uptake ในบริเวณที่เคยมีก้อนมะเร็ง
นอกจากนี้ การรักษาแบบ unilobar Y-90 TARE หรือ Radiation lobectomy(48) ซึ่งเป็นการรักษาด้วยรังสีปริมาณสูงที่ตับข้างใดข้างหนึ่งเพื่อทำให้ก้อนมีขนาดเล็กลง, lobar atrophy พร้อมกับ contralateral lobar hypertrophy โดยพบว่ามี FLR hypertrophy rate ร้อยละ 26 ถึง 47 จากผลการรักษาดังกล่าว Y-90 TARE จึงช่วยเพิ่มโอกาสการรักษาด้วยการผ่าตัดได้(49) (รูปที่ 15.) โดย tumor dose และ non-tumor dose ที่เหมาะสมสำหรับ Radiation lobectomy คือ >250Gy และ <70Gy สำหรับ resin microsphere หรือ >205Gy และ >88Gy สำหรับ glass microsphere(47) จากการเก็บข้อมูลของผู้ป่วยที่ได้รับการรักษาดังกล่าว 73 ราย พบกว่ามี response rate ร้อยละ 94.5, 3-month disease control rate ร้อยละ 98.6 และ 3-month disease control rate ร้อยละ 71.2(50) ทั้งนี้ FLR hypertrophy rate หลังการทำ Y-90 TARE จะช้ากว่าเมื่อเปรียบเทียบกับการทำ PVE โดยแนะนำให้ประเมิน resectability และ FLR hypertrophy หลังจากการรักษาด้วย Y-90 TARE ในช่วง 3-6 เดือน(50)
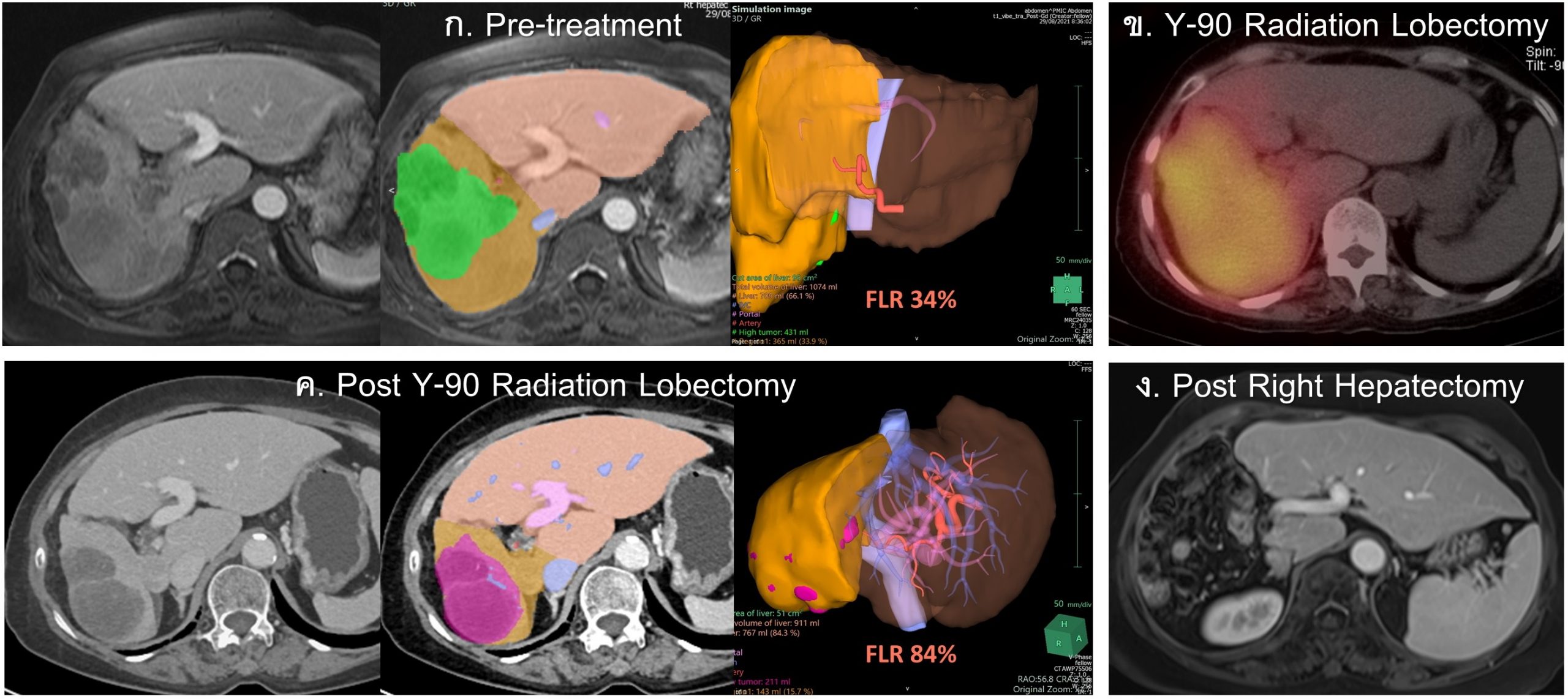
รูปที่ 15- Yttrium-90 Radiation Lobectomy and Y90-induced Liver Hypertrophy. ผู้ป่วยหญิงอายุ 67 ปี underlying chronic HBV, CTP score 5, ก. MRI with volumetry measurement ก่อนการรักษา พบ multiple HCCs in right lobe และ right portal vein tumor thrombus (PVTT), ข. ภาพ Bremsstrahlung SPECT-CT 3 ชั่วโมง หลังการรักษา ด้วย Y-90 TARE/ Radiation Lobectomy พบว่ามี radioactivity ทั่ว right hepatic lobe รวมทั้ง right PVTT, ค. ภาพ CT with CT volumetry measurement หลังการรักษา 3 เดือน พบ extensive tumor necrosis, ก้อนมะเร็งมีขนาดเล็กลง, right lobe atrophy และ left lobe hypertrophy เมื่อคำนวณ future liver remnant (FLR) เพื่อขึ้นจากร้อยละ 34 (ก่อนการรักษา) เป็นร้อยละ 84 ผู้ป่วยได้รับการผ่าตัด right hepatectomy 5 เดือนหลัง Y-90 TARE, ง. MRI หลังการผ่าตัด 3 ปี ไม่มี recurrence tumor
หลังจากการศึกษา phase II RCT trial ในปี 2021(51) พบว่าการตอบสนองต่อการรักษา (treatment response) ด้วย Y-90 TARE แปรผันโดยตรงกับ tumor absorbed dose โดยพบว่า objective response และ อัตรารอดชีวิตในกลุ่ม personalized dosimetry (>205Gy) คือ OR ร้อยละ 71 และ OS 24.8 เดือน เมื่อเปรียบเทียบกับ standard dosimetry (120±20Gy) คือ OR ร้อยละ 36 และ OS 10.7 เดือน ซึ่งดีขึ้นอย่างมีนัยสำคัญทางสถิติ(51, 52) ดังนั้นในปัจจุบันการรักษา HCC ไม่ว่าจะในระยะใดก็ตาม ควรวางแผนแบบ personalized dosimetry เพื่อคำนวนให้ได้รับรังสีปริมาณสูงที่สุดตามขนาดก้อน ปริมาตรตับ และ vascular anatomy ของผู้ป่วยแต่ละรายจึงมีความสำคัญอย่างยิ่ง
หากเปรียบเทียบกับ TACE การรักษาด้วย Y-90 TARE มีโอกาสลดขนาดของก้อนมะเร็งสูงกว่า(53) ช่วยควบคุมโรค (time to progression และ duration of response) ได้นานกว่า(54, 55) และ toxicity น้อยกว่า(56) ถึงแม้การศึกษาแบบ RCT เปรียบเทียบระหว่าง TACE และ Y-90 ที่ผ่านมาพบว่าอัตราการรอดชีวิตของผู้ป่วยจากการรักษาทั้ง 2 วิธีนี้จะไม่มีความแตกต่างกันอย่างมีนัยสำคัญทางสถิติ แต่การศึกษา RCT ทั้งหมดไม่ได้ใช้ personalized dosimetry ในการวางแผนการรักษา ดังนั้น การศึกษาเปรียบเทียบ Y-90 TARE ต่อไปในอนาคตจึงจำเป็นต้องคำนึงถึงปัจจัยนี้ด้วย(41)
Y-90 TARE มีบทบาทใน Asian guidelines(4, 27, 29, 42, 57, 58) เป็นทางเลือกในการรักษาผู้ป่วย unresectable HCC โดยถูกแนะนำให้เลือกใช้กับผู้ป่วยที่ไม่เหมาะสมต่อการรักษาด้วย TACE เช่น ก้อนขนาดใหญ่ (single large HCC), bulky or multifocal unilobar disease, locally-advanced portal vein invasion, downstaging/downsizing to surgery หรือไม่ตอบสนองต่อ TACE หรือมี severe post embolization syndrome โดยผู้ป่วยต้องมีสภาพการทำงานของตับในเกณฑ์ดี ค่า serum bilirubin ไม่ควรเกิน 2 mg/dL(40)
ข้อด้อยที่สำคัญของ Y-90 TARE คือมีราคาสูง และมีความยุ่งยากซับซ้อนในการรักษามากกว่าการทำ TACE โดยก่อนการรักษาแพทย์จะต้องตรวจ pre-treatment work-up angiography อย่างละเอียดเพื่อประเมิน tumor burden และ vascular anatomy ร่วมกับการฉีดสาร Tc-99m macroaggregated albumin (MAA) ที่มีขนาดใกล้เคียงกับ Y-90 microsphere เข้าไปทาง hepatic artery ที่ไปเลี้ยงก้อนมะเร็ง เพื่อทดสอบดู radioactivity uptake และวัด hepatopulmonary shunt (รูปที่ 16.) นอกจากนี้อาจต้องพิจารณาทำ prophylactic embolization เพื่อป้องกัน non-target embolization ของ Y-90 microspheres ไปยังอวัยวะข้างเคียง เช่น กระเพาะ หรือลำไส้ โดยหลังจากฉีดสาร Tc-99m MAA ผู้ป่วยจะถูกส่งตัวไปตรวจที่แผนก nuclear medicine ด้วย gamma camera และ SPECT-CT ร่วมกับการคำนวน hepatopulmonary shunt หากผลการตรวจทดสอบพบว่ามี radioactivity uptake สูงในตำแหน่งก้อนมะเร็งตามที่ต้องการ และผู้ป่วยไม่มีข้อห้ามในการรักษา แพทย์จึงจะคำนวณปริมาณสารรังสีที่จะใช้รักษา และทำ angiography อีกครั้งเพื่อฉีด Y-90 microspheres ตามที่ได้วางแผนไว้
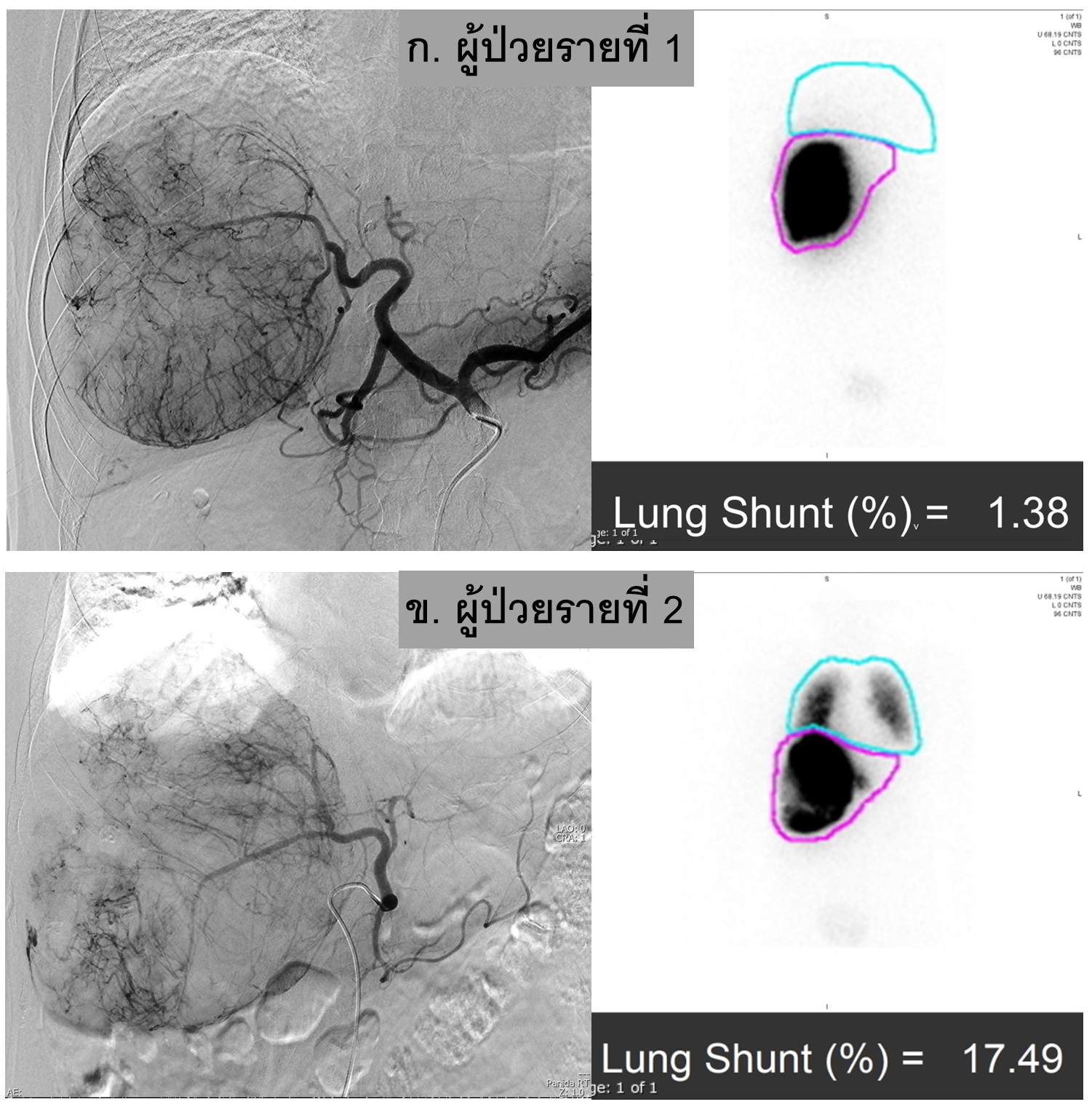
รูปที่ 16- Hepatopulmonary shunt in HCC. ภาพเปรียบเทียบผู้ป่วย Large HCC ที่มี low hepatopulmonary shunt (ผู้ป่วยรายที่ 1, Lung shunt 1.38%) และ high hepatopulmonary shunt (ผู้ป่วยรายที่ 2, Lung shunt 17.49%) โดยวัดจาก planar image เปรียบเทียบ radioactivity ใน region of interest (ROI) ของปอด (เส้นสีฟ้า) และ ตับ (เส้นสีชมพู)
Absolute contraindication ในการทำ Y-90 TARE ได้แก่
- Hepatopulmonary shunt สูง (lung dose มากกว่า 30 Gy ต่อการรักษา 1 ครั้ง หรือ cumulative lung dose มากกว่า 50 Gy)
- Extrahepatic radioactivity uptake โดยเฉพาะ GI tract ที่ไม่สามารถแก้ไขได้
หลังจากฉีดสาร Y-90 microsphere แล้ว ผู้ป่วยจะได้รับการทำ nuclear scan ด้วย Bremsstrahlung scan และ SPECT-CT หรือ PET-CT เพื่อประเมิน radioactivity uptake จากการรักษา แพทย์จะนัดประเมินผลการรักษาด้วย CT หรือ MRI ร่วมกับค่าการทำงานของตับและ tumor marker โดยก้อนมักมีขนาดเล็กลงภายใน 3-6 เดือน
การรักษามะเร็งตับโดยการทำลายก้อนมะเร็งเฉพาะที่ด้วยวิธีอื่นๆ (Other Locoregional Treatment)
การฉีดแอลกอฮอล์เข้าไปยังก้อนมะเร็งตับ (Percutaneous Ethanol Injection Therapy)
Percutaneous ethanol injection therapy หรือ PEIT อาศัยการทำลายเนื้อเยื่อเฉพาะที่ด้วย ethanol ความเข้มข้นสูงมากกว่าร้อยละ 95 ขึ้นไป (chemical ablation) เป็นการรักษาที่ทำได้ง่าย, สะดวก, ปลอดภัย และราคาถูก โดยแพทย์จะฉีดยาชาเฉพาะที่แล้วใช้เข็มขนาดเล็กแทงผ่านผิวหนังเข้าไปยังก้อนมะเร็งที่ต้องการรักษา โดยส่วนมากอาศัยภาพ ultrasound ช่วยนำทาง
การรักษาโดยวิธี PEIT ให้ผลการรักษาด้อยกว่า tumor ablation วิธีอื่นๆ(59) ในปัจจุบันอาจจะพิจารณาเลือกใช้ PEIT เป็นการรักษาเสริมในบางกรณี เช่น ในก้อนมะเร็งที่มีขนาดไม่เกิน 1.5 เซนติเมตรที่ได้ผลการรักษาเทียบเท่า RFA(60) หรือ ใช้ PEIT ร่วมกับการรักษาด้วย Ablation(59) หรือ TACE(61) เพื่อเสริมเพิ่มประสิทธิภาพของ locoregional treatment
การรักษามะเร็งตับด้วยการฉายรังสี (External Beam Radiation)
ในอดีตการรักษามะเร็งตับด้วยการฉายแสงไม่ได้ประโยชน์เนื่องจากเนื้อเยื่อตับปกติทนปริมาณรังสีได้น้อย แต่ในปัจจุบันเทคนิคการฉายรังสีพัฒนาไปมากจนสามารถกำหนดตำแหน่งการฉายรังสีไปยังก้อนมะเร็งได้อย่างแม่นยำด้วยการวางแผนแบบ 3 มิติ และลดปริมาณรังสีที่เนื้อเยื่อปกติโดยรอบจะได้รับ จึงทำให้การฉายรังสีมีบทบาทมากขึ้นในการรักษามะเร็งตับ
ข้อบ่งชี้ในการรักษาผู้ป่วยมะเร็งตับด้วยการฉายรังสี ได้แก่
- เพื่อเป็นทางเลือกในกรณีที่ผู้ป่วยมะเร็งตับไม่สามารถรักษาด้วยวิธีอื่น ยกตัวอย่างเช่น การรักษา HCC with macrovascular invasion ด้วย TACE plus RT(20, 27) (รูปที่ 17.)
- เพื่อเสริมประสิทธิภาพร่วมกับการรักษาด้วย locoregional treatment(27, 62) หรือ systemic treatment (42) (รูปที่ 18.)
- เพื่อรักษามะเร็งที่แพร่กระจายออกนอกตับ เช่น bone metastases(4)
โดยทั่วไปเทคนิคการฉายรังสีเพื่อรักษามะเร็งตับด้วยโฟตอน (photon) ได้แก่ Intensity Modulated Radiotherapy (IMRT), Volumetric Modulated Arc Therapy (VMAT) หรือ Stereotactic Body Radiotherapy (SBRT) เป็นต้น
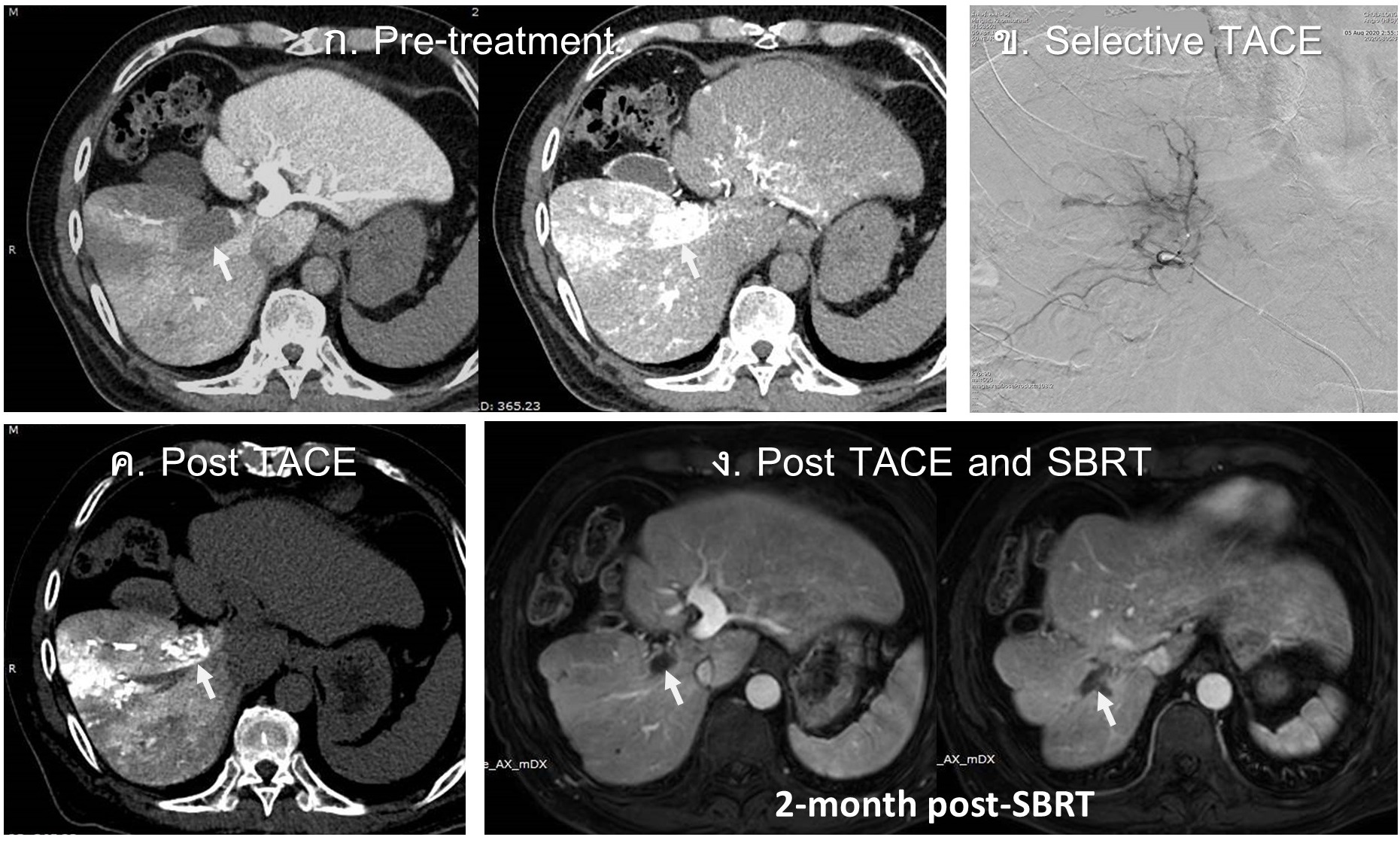
รูปที่ 17- Combined selective TACE with SBRT in HCC with portal vein tumor thrombus (PVTT). ก. และข. ภาพ catheter-directed CT arteriopotography (ซ้าย) และ CT hepatic angiography (ขวา) ก่อนการรักษา พบ enhancing tumor thrombus ใน right portal vein (arrow) และ ill-defined tumor enhancement ใน anterior segment of right hepatic lobe, ข. Selective angiography in artery feeding tumor thrombus ในการทำ TACE, ค. Non-contrast CT ทันทีหลังการรักษาด้วย selective TACE พบ Lipiodol staining ใน right PVTT และ heterogeneous Lipiodol staining ใน right hepatic lobe ผู้ป้วยได้รับการรักษาเพิ่มเติมด้วย SBRT หลัง TACE 1 เดือน, ง. ภาพ MRI หลัง SBRT 2 เดือน พบว่า tumor thrombus (arrow) มีขนาดเล็กลง และไม่เห็น internal enhancement ชัดเจน
นอกจากนี้ยังมีการฉายรังสีด้วยอนุภาคโปรตอน (Proton Beam Therapy, PBT)(63) ซึ่งมีข้อดีที่เหนือกว่า การฉายรังสีด้วยโฟตอน เนื่องจากคุณสมบัติเฉพาะตัวของการกระจายรังสี (dosimetry) ที่จะปล่อยพลังงานสูงมากเมื่อถึงความลึกระดับหนึ่ง และลดต่ำลงอย่างรวดเร็วหลังจากนั้น ทำให้ก้อนมะเร็งได้รับรังสีสูงมากพอที่จะควบคุมโรคเฉพาะที่และตับปกติใกล้เคียงได้รับปริมาณรังสีน้อย ลดความเสี่ยงต่อการเกิด radiation-induced liver disease (RILD) ดังนั้นการฉายรังสีอนุภาคโปรตอนจึงมีประสิทธิภาพในการรักษาก้อนมะเร็งในตับโดยรวมดีกว่าการฉายรังสีด้วยโฟตอน (รูปที่ 18.)
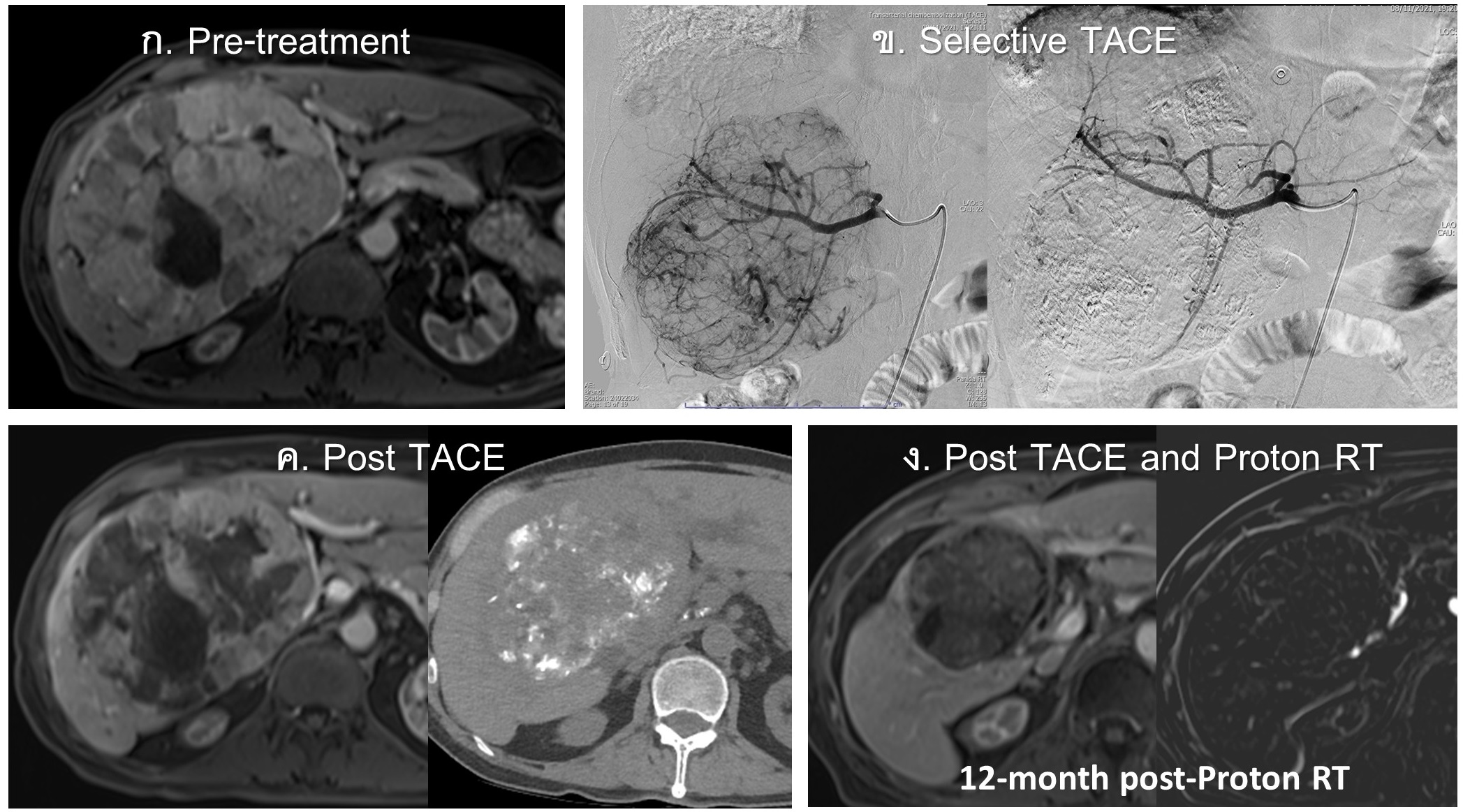
รูปที่ 18- Large HCC treated with TACE and Proton Beam Therapy. ก. ภาพ MRI arterial-phase พบ large HCC ขนาด 13 เซนติเมตร, ข. Hepatic angiography ก่อน (ซ้าย) และหลัง (ขวา) การรักษาด้วย selective TACE, ค. ภาพ MRI (ซ้าย) และ non-contrast CT (ขวา) ติดตามหลังการรักษา 1 เดือน พบ partial tumor necrosis, partial lipiodol staining (<50%) และ ก้อนมีขนาดเล็กลงเล็กน้อย ผู้ป่วยได้รับการรักษาต่อด้วย proton beam therapy 2 เดือนหลังจาก TACE, ง. ภาพ MRI venous-phase (ซ้าย) และ arterial-phase subtraction (ขวา) หลังการรักษาด้วย proton beam therapy 1 ปี พบก้อนมีขนาดเล็กลง (6 เซนติเมตร) และ ไม่มี arterial enhancement
บทสรุป
ผู้ป่วยมะเร็งตับ HCC ส่วนใหญ่ไม่สามารถรับการรักษาด้วยการผ่าตัดได้เมื่อได้รับการวินิจฉัยโรค หรือพบว่ากลับเป็นซ้ำหลังจากการรักษาด้วยการผ่าตัด ดังนั้นการรักษามะเร็งตับโดยการทำลายก้อนมะเร็งเฉพาะที่โดยตรง (Locoregional treatment หรือ Liver-directed therapies) จึงมีบทบาทสำคัญอย่างยิ่งในการดูแลรักษาผู้ป่วยมะเร็งตับให้มีอัตราการรอดชีวิตยาวนานขึ้น รวมทั้งมีคุณภาพชีวิตที่ดีด้วย
เทคโนโลยีการรักษาที่ก้าวหน้าในปัจจุบันช่วยเพิ่มประสิทธิภาพและลดข้อจำกัดของการรักษาทั้งแบบPercutanoeus tumor ablation และ Transarterial treatment ตลอดจนมีวิธีการรักษาที่หลากหลายมากขึ้น ทั้งนี้การเลือกวิธีการรักษาให้เหมาะสม (patient selection) กับลักษณะของก้อนมะเร็ง การทำงานโดยรวมของตับ รวมทั้งสภาพร่างกายของผู้ป่วยแต่ละรายจึงถือเป็นหัวใจสำคัญ โดยการวางแผนการรักษาร่วมกันระหว่างทีมแพทย์ผู้เชี่ยวชาญเฉพาะทางที่เกี่ยวข้อง ได้แก่ ศัลยแพทย์โรคตับ อายุรแพทย์โรคตับ แพทย์รังสีร่วมรักษา อายุรแพทย์โรคมะเร็ง และอื่นๆ จะช่วยให้การดูแลผู้ป่วยมะเร็งแบบองค์รวมเกิดประสิทธิภาพสูงสุด
References
- Reig M, Forner A, Rimola J, Ferrer-Fàbrega J, Burrel M, Garcia-Criado Á, et al. BCLC strategy for prognosis prediction and treatment recommendation: The 2022 update. J Hepatol. 2022;76(3):681-93.
- Cho YK, Kim JK, Kim WT, Chung JW. Hepatic resection versus radiofrequency ablation for very early stage hepatocellular carcinoma: a Markov model analysis. Hepatology. 2010;51(4):1284-90.
- Cucchetti A, Piscaglia F, Cescon M, Colecchia A, Ercolani G, Bolondi L, Pinna AD. Cost-effectiveness of hepatic resection versus percutaneous radiofrequency ablation for early hepatocellular carcinoma. J Hepatol. 2013;59(2):300-7.
- Omata M, Cheng AL, Kokudo N, Kudo M, Lee JM, Jia J, et al. Asia-Pacific clinical practice guidelines on the management of hepatocellular carcinoma: a 2017 update. Hepatol Int. 2017;11(4):317-70.
- Mazzaferro V, Battiston C, Perrone S, Pulvirenti A, Regalia E, Romito R, et al. Radiofrequency ablation of small hepatocellular carcinoma in cirrhotic patients awaiting liver transplantation: a prospective study. Ann Surg. 2004;240(5):900-9.
- Lu DS, Raman SS, Vodopich DJ, Wang M, Sayre J, Lassman C. Effect of vessel size on creation of hepatic radiofrequency lesions in pigs: assessment of the “heat sink” effect. AJR Am J Roentgenol. 2002;178(1):47-51.
- Huo YR, Eslick GD. Microwave Ablation Compared to Radiofrequency Ablation for Hepatic Lesions: A Meta-Analysis. J Vasc Interv Radiol. 2015;26(8):1139-46.e2.
- Lupo L, Panzera P, Giannelli G, Memeo M, Gentile A, Memeo V. Single hepatocellular carcinoma ranging from 3 to 5 cm: radiofrequency ablation or resection? HPB (Oxford). 2007;9(6):429-34.
- Young S, Golzarian J. Locoregional Therapies in the Treatment of 3- to 5-cm Hepatocellular Carcinoma: Critical Review of the Literature. AJR Am J Roentgenol. 2020;215(1):223-34.
- Glazer DI, Tatli S, Shyn PB, Vangel MG, Tuncali K, Silverman SG. Percutaneous Image-Guided Cryoablation of Hepatic Tumors: Single-Center Experience With Intermediate to Long-Term Outcomes. AJR Am J Roentgenol. 2017;209(6):1381-9.
- Ma J, Wang F, Zhang W, Wang L, Yang X, Qian Y, et al. Percutaneous cryoablation for the treatment of liver cancer at special sites: an assessment of efficacy and safety. Quant Imaging Med Surg. 2019;9(12):1948-57.
- Narayanan G, Froud T, Suthar R, Barbery K. Irreversible electroporation of hepatic malignancy. Semin Intervent Radiol. 2013;30(1):67-73.
- Cheung W, Kavnoudias H, Roberts S, Szkandera B, Kemp W, Thomson KR. Irreversible electroporation for unresectable hepatocellular carcinoma: initial experience and review of safety and outcomes. Technol Cancer Res Treat. 2013;12(3):233-41.
- Daniels JR. Overall survival after transarterial lipiodol infusion chemotherapy with or without embolization for unresectable hepatocellular carcinoma: propensity score analysis. AJR Am J Roentgenol. 2011;196(2):W220.
- Ikeda M, Arai Y, Park SJ, Takeuchi Y, Anai H, Kim JK, et al. Prospective study of transcatheter arterial chemoembolization for unresectable hepatocellular carcinoma: an Asian cooperative study between Japan and Korea. J Vasc Interv Radiol. 2013;24(4):490-500.
- Takayasu K, Arii S, Kudo M, Ichida T, Matsui O, Izumi N, et al. Superselective transarterial chemoembolization for hepatocellular carcinoma. Validation of treatment algorithm proposed by Japanese guidelines. J Hepatol. 2012;56(4):886-92.
- Yamakado K, Miyayama S, Hirota S, Mizunuma K, Nakamura K, Inaba Y, et al. Hepatic arterial embolization for unresectable hepatocellular carcinomas: do technical factors affect prognosis? Jpn J Radiol. 2012;30(7):560-6.
- EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol. 2018;69(1):182-236.
- de Baere T, Ronot M, Chung JW, Golfieri R, Kloeckner R, Park JW, et al. Initiative on Superselective Conventional Transarterial Chemoembolization Results (INSPIRE). Cardiovasc Intervent Radiol. 2022;45(10):1430-40.
- Lu J, Zhao M, Arai Y, Zhong BY, Zhu HD, Qi XL, et al. Clinical practice of transarterial chemoembolization for hepatocellular carcinoma: consensus statement from an international expert panel of International Society of Multidisciplinary Interventional Oncology (ISMIO). Hepatobiliary Surg Nutr. 2021;10(5):661-71.
- Levent Akman Solim DA, Thomas J. Vogl. The efficacy of cone-beam computed tomography-guided transcatheter arterial chemoembolization in hepatocellular carcinoma survival: A systematic review. Journal of Clinical Imaging Science. 2024;14(1):1-10.
- Ekajchariya K PN, Kosolpun P. Extrahepatic collateral blood supply of hepatocellular carcinoma : Prevalence and success rate of chemoembolization in King Chulalongkorn Memorial Hospital. Chula Med J 2013;57(1):25-37.
- Kim HC, Chung JW, Lee W, Jae HJ, Park JH. Recognizing extrahepatic collateral vessels that supply hepatocellular carcinoma to avoid complications of transcatheter arterial chemoembolization. Radiographics. 2005;25 Suppl 1:S25-39.
- Miksad RA, Ogasawara S, Xia F, Fellous M, Piscaglia F. Liver function changes after transarterial chemoembolization in US hepatocellular carcinoma patients: the LiverT study. BMC Cancer. 2019;19(1):795.
- Geschwind JD, Michael. Abrams’ Angiography: Interventional Radiology: Third Edition.: Wolters Kluwer Health Adis (ESP); 2013. 1240 p.
- Bargellini I, Sacco R, Bozzi E, Bertini M, Ginanni B, Romano A, et al. Transarterial chemoembolization in very early and early-stage hepatocellular carcinoma patients excluded from curative treatment: a prospective cohort study. Eur J Radiol. 2012;81(6):1173-8.
- Cheung TT, Yu SC, Chan SL, Poon RTP, Kwok P, Lee AS, et al. The Hong Kong consensus statements on unresectable hepatocellular carcinoma: narrative review and update for 2021. Hepatobiliary Surg Nutr. 2023;12(3):366-85.
- Golfieri R, Bargellini I, Spreafico C, Trevisani F. Patients with Barcelona Clinic Liver Cancer Stages B and C Hepatocellular Carcinoma: Time for a Subclassification. Liver Cancer. 2019;8(2):78-91.
- สมาคมโรคตับแห่งประเทศไทย. TAftSotLT. Thailand Guideline for Management of Hepatocellular Carcinoma 2021. แนวทางการดูแลผู้ป่วยมะเร็งตับในประเทศไทย ปี พ.ศ. 2564 (ฉบับปรับปรุง). 2021. Available from: https://thasl.org/thasl-guideline/.
- Iezzi R, Pompili M, Posa A, Annicchiarico E, Garcovich M, Merlino B, et al. Transradial versus Transfemoral Access for Hepatic Chemoembolization: Intrapatient Prospective Single-Center Study. J Vasc Interv Radiol. 2017;28(9):1234-9.
- Kudo M, Matsui O, Izumi N, Kadoya M, Okusaka T, Miyayama S, et al. Transarterial chemoembolization failure/refractoriness: JSH-LCSGJ criteria 2014 update. Oncology. 2014;87 Suppl 1:22-31.
- Imamura H, Seyama Y, Makuuchi M, Kokudo N. Sequential transcatheter arterial chemoembolization and portal vein embolization for hepatocellular carcinoma: the university of Tokyo experience. Semin Intervent Radiol. 2008;25(2):146-54.
- van Lienden KP, van den Esschert JW, de Graaf W, Bipat S, Lameris JS, van Gulik TM, van Delden OM. Portal vein embolization before liver resection: a systematic review. Cardiovasc Intervent Radiol. 2013;36(1):25-34.
- Varela M, Real MI, Burrel M, Forner A, Sala M, Brunet M, et al. Chemoembolization of hepatocellular carcinoma with drug eluting beads: efficacy and doxorubicin pharmacokinetics. J Hepatol. 2007;46(3):474-81.
- Bzeizi KI, Arabi M, Jamshidi N, Albenmousa A, Sanai FM, Al-Hamoudi W, et al. Conventional Transarterial Chemoembolization Versus Drug-Eluting Beads in Patients with Hepatocellular Carcinoma: A Systematic Review and Meta-Analysis. Cancers (Basel). 2021;13(24).
- Lammer J, Malagari K, Vogl T, Pilleul F, Denys A, Watkinson A, et al. Prospective randomized study of doxorubicin-eluting-bead embolization in the treatment of hepatocellular carcinoma: results of the PRECISION V study. Cardiovasc Intervent Radiol. 2010;33(1):41-52.
- Golfieri R, Giampalma E, Renzulli M, Cioni R, Bargellini I, Bartolozzi C, et al. Randomised controlled trial of doxorubicin-eluting beads vs conventional chemoembolisation for hepatocellular carcinoma. Br J Cancer. 2014;111(2):255-64.
- Jia Z, Jiang G, Tian F, Zhu C, Qin X. A systematic review on the safety and effectiveness of yttrium-90 radioembolization for hepatocellular carcinoma with portal vein tumor thrombosis. Saudi J Gastroenterol. 2016;22(5):353-9.
- Bargellini I, Scalise P, Boni G, Traino CA, Bozzi E, Lorenzoni G, et al. Yttrium-90 Radioembolization for Hepatocellular Carcinoma with Portal Vein Invasion: Validation of the Milan Prognostic Score. J Vasc Interv Radiol. 2020;31(12):2028-32.
- Lewandowski RJ, Sato KT, Atassi B, Ryu RK, Nemcek AA, Jr., Kulik L, et al. Radioembolization with 90Y microspheres: angiographic and technical considerations. Cardiovasc Intervent Radiol. 2007;30(4):571-92.
- Singal AG, Llovet JM, Yarchoan M, Mehta N, Heimbach JK, Dawson LA, et al. AASLD Practice Guidance on prevention, diagnosis, and treatment of hepatocellular carcinoma. Hepatology. 2023;78(6):1922-65.
- 2022 KLCA-NCC Korea practice guidelines for the management of hepatocellular carcinoma. Clin Mol Hepatol. 2022;28(4):583-705.
- Liu DM, Leung TW, Chow PK, Ng DC, Lee RC, Kim YH, et al. Clinical consensus statement: Selective internal radiation therapy with yttrium 90 resin microspheres for hepatocellular carcinoma in Asia. Int J Surg. 2022;102:106094.
- Toskich B, Vidal LL, Olson MT, Lewis JT, LeGout JD, Sella DM, et al. Pathologic Response of Hepatocellular Carcinoma Treated with Yttrium-90 Glass Microsphere Radiation Segmentectomy Prior to Liver Transplantation: A Validation Study. J Vasc Interv Radiol. 2021;32(4):518-26.e1.
- Biederman DM, Titano JJ, Bishay VL, Durrani RJ, Dayan E, Tabori N, et al. Radiation Segmentectomy versus TACE Combined with Microwave Ablation for Unresectable Solitary Hepatocellular Carcinoma Up to 3 cm: A Propensity Score Matching Study. Radiology. 2017;283(3):895-905.
- Padia SA, Johnson GE, Horton KJ, Ingraham CR, Kogut MJ, Kwan S, et al. Segmental Yttrium-90 Radioembolization versus Segmental Chemoembolization for Localized Hepatocellular Carcinoma: Results of a Single-Center, Retrospective, Propensity Score-Matched Study. J Vasc Interv Radiol. 2017;28(6):777-85.e1.
- Villalobos A, Pisanie JLD, Gandhi RT, Kokabi N. Yttrium-90 Radioembolization Dosimetry: Dose Considerations, Optimization, and Tips. Semin Intervent Radiol. 2024;41(1):63-78.
- Teo JY, Allen JC, Jr., Ng DC, Choo SP, Tai DW, Chang JP, et al. A systematic review of contralateral liver lobe hypertrophy after unilobar selective internal radiation therapy with Y90. HPB (Oxford). 2016;18(1):7-12.
- Khan A, Sayles HR, Dhir M. Liver resection after Y-90 radioembolization: a systematic review and meta-analysis of perioperative morbidity and mortality. HPB (Oxford). 2022;24(2):152-60.
- Palard X, Edeline J, Rolland Y, Le Sourd S, Pracht M, Laffont S, et al. Dosimetric parameters predicting contralateral liver hypertrophy after unilobar radioembolization of hepatocellular carcinoma. Eur J Nucl Med Mol Imaging. 2018;45(3):392-401.
- Garin E, Tselikas L, Guiu B, Chalaye J, Edeline J, de Baere T, et al. Personalised versus standard dosimetry approach of selective internal radiation therapy in patients with locally advanced hepatocellular carcinoma (DOSISPHERE-01): a randomised, multicentre, open-label phase 2 trial. Lancet Gastroenterol Hepatol. 2021;6(1):17-29.
- Garin E, Tselikas L, Guiu B, Chalaye J, Rolland Y, de Baere T, et al. Long-Term Overall Survival After Selective Internal Radiation Therapy for Locally Advanced Hepatocellular Carcinomas: Updated Analysis of DOSISPHERE-01 Trial. J Nucl Med. 2024;65(2):264-9.
- Lewandowski RJ, Kulik LM, Riaz A, Senthilnathan S, Mulcahy MF, Ryu RK, et al. A comparative analysis of transarterial downstaging for hepatocellular carcinoma: chemoembolization versus radioembolization. Am J Transplant. 2009;9(8):1920-8.
- Salem R, Gordon AC, Mouli S, Hickey R, Kallini J, Gabr A, et al. Y90 Radioembolization Significantly Prolongs Time to Progression Compared With Chemoembolization in Patients WithHepatocellular Carcinoma. Gastroenterology. 2016;151(6):1155-63.e2.
- Dhondt E, Lambert B, Hermie L, Huyck L, Vanlangenhove P, Geerts A, et al. (90)Y Radioembolization versus Drug-eluting Bead Chemoembolization for Unresectable Hepatocellular Carcinoma: Results from the TRACE Phase II Randomized Controlled Trial. Radiology. 2022;303(3):699-710.
- Yang Y, Si T. Yttrium-90 transarterial radioembolization versus conventional transarterial chemoembolization for patients with hepatocellular carcinoma: a systematic review and meta-analysis. Cancer Biol Med. 2018;15(3):299-310.
- Shao YY, Wang SY, Lin SM. Management consensus guideline for hepatocellular carcinoma: 2020 update on surveillance, diagnosis, and systemic treatment by the Taiwan Liver Cancer Association and the Gastroenterological Society of Taiwan. J Formos Med Assoc. 2021;120(4):1051-60.
- Cheung TT, Kwok PC, Chan S, Cheung CC, Lee AS, Lee V, et al. Hong Kong Consensus Statements for the Management of Unresectable Hepatocellular Carcinoma. Liver Cancer. 2018;7(1):40-54.
- Luo W, Zhang Y, He G, Yu M, Zheng M, Liu L, Zhou X. Effects of radiofrequency ablation versus other ablating techniques on hepatocellular carcinomas: a systematic review and meta-analysis. World J Surg Oncol. 2017;15(1):126.
- Yu SJ, Yoon JH, Lee JM, Lee JY, Kim SH, Cho YY, et al. Percutaneous ethanol injection therapy is comparable to radiofrequency ablation in hepatocellular carcinoma smaller than 1.5 cm: A matched case-control comparative analysis. Medicine (Baltimore). 2016;95(35):e4551.
- Becker G, Soezgen T, Olschewski M, Laubenberger J, Blum HE, Allgaier HP. Combined TACE and PEI for palliative treatment of unresectable hepatocellular carcinoma. World J Gastroenterol. 2005;11(39):6104-9.
- Schwarz RE, Abou-Alfa GK, Geschwind JF, Krishnan S, Salem R, Venook AP. Nonoperative therapies for combined modality treatment of hepatocellular cancer: expert consensus statement. HPB (Oxford). 2010;12(5):313-20.
- อมรวิเชษฐ์ ณ. Proton therapy in hepatocellular carcinoma บทบาทของการรักษาด้วยอนุภาคโปรตอนในโรคมะเร็งตับปฐมภูมิ. Journal of Thai Association of Radiation Oncology 2018;24(2):74-80.




